Содержание
- 2. Определение Гетерогенный катализ – каталитические реакции, идущие на поверхности раздела фаз, образуемых катализатором и реагирующими веществами.
- 3. В промышленности применяют катализаторы: в виде цилиндров, гранул диаметром несколько миллиметров, а также катализаторы, получаемые нанесением
- 4. Теории катализа Из-за очень малых концентраций нанесенного металла на поверхности носителей находятся не микрокристаллы, а небольшие
- 5. Катализаторы Для повышения активности, термодинамической устойчивости, механической жесткости применяют катализаторы в виде многокомпонентных систем - смешанные
- 6. Промоторы Промоторы (активаторы), не имеют каталитические свойства, но повышают каталитическую активность катализатора. Например, для железного катализатора
- 7. Для катализируемой металлическим никелем реакции СО + Н2 ––> СН4 + Н2О введение небольшой примеси церия
- 8. Классы гетерогенных катализаторов
- 9. Катализ Металлическая платина (показана стрелками), стабили-зированная на носителе — оксиде алюминия
- 10. Адсорбционная теория гетерогенного катализа Термин адсорбция означает накопление молекул на поверхности раздела фаз. Различают адсорбцию двух
- 11. Активные центры Для объяснения особенностей гетерогенно-каталитических процессов Г. Тэйлором было высказано следующее предположение: каталитически активной является
- 12. Активные центры Активные центры – свободные участки поверхности, где могут адсорбироваться молекулы реагирующих веществ. Другая часть
- 13. Физическая адсобция Физическая адсорбция протекает уже при низких температурах достаточно быстро с малой энергией активации. Температурная
- 14. Химическая адсобция Хемосорбция представляет собой поверхностную химическую реакцию, не сопровождающееся образованием объемной фазы. Cилы, удерживающие молекулы
- 15. Химическая адсобция Значения энтальпии хемосорбции лежат в широком интервале, они превышают в большинстве случаев по абсолютной
- 16. Мультиплетная теория катализа А.А. Баландина В настоящее время нет единой теории гет. катализа. Основные положения теории
- 17. Теорию мультиплетов называют иногда теорией геометрического подобия активного центра и реагирующих молекул. Для различных реакций число
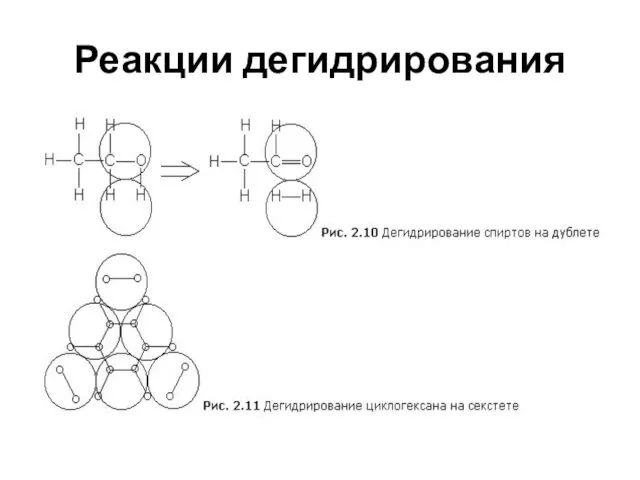
- 18. Реакции дегидрирования
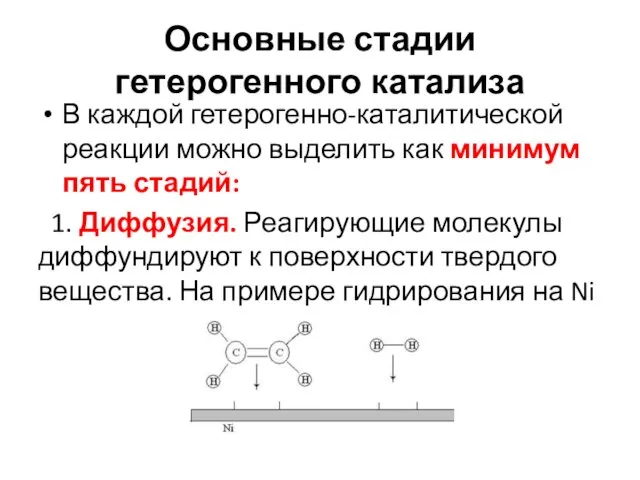
- 19. Основные стадии гетерогенного катализа В каждой гетерогенно-каталитической реакции можно выделить как минимум пять стадий: 1. Диффузия.
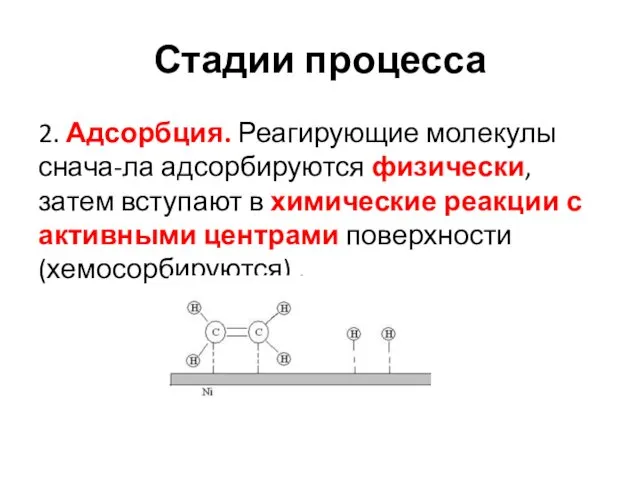
- 20. Стадии процесса 2. Адсорбция. Реагирующие молекулы снача-ла адсорбируются физически, затем вступают в химические реакции с активными
- 21. Полимолекулярная адсорбция При физической адсорбции, если энергии межмолекулярных связей соизмеримы, после насыщения первого адсорбционного слоя наступает
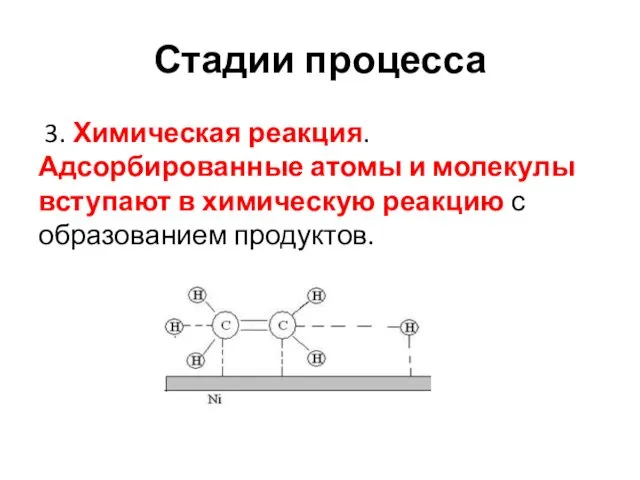
- 22. Стадии процесса 3. Химическая реакция. Адсорбированные атомы и молекулы вступают в химическую реакцию с образованием продуктов.
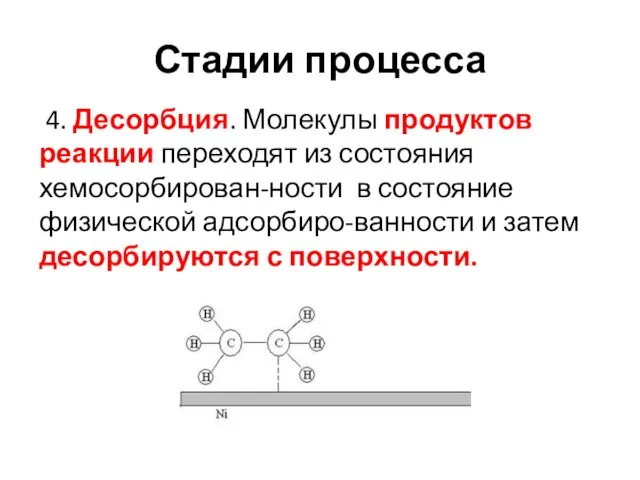
- 23. Стадии процесса 4. Десорбция. Молекулы продуктов реакции переходят из состояния хемосорбирован-ности в состояние физической адсорбиро-ванности и
- 24. Обратимость десорбции В связи с высокой экзотермичностью большинства процессов хемосорбции десорбция может иметь место только при
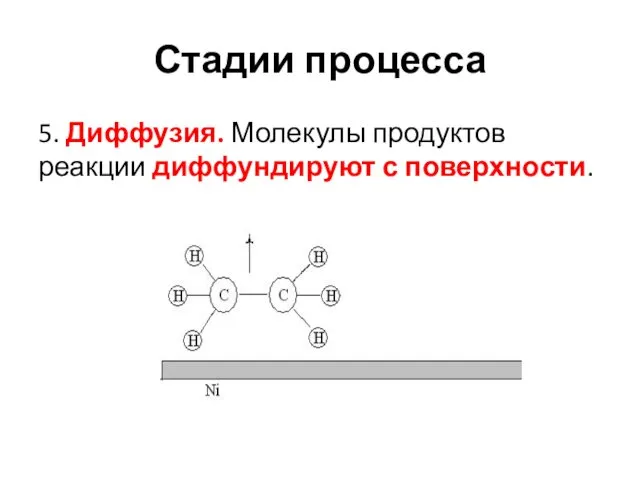
- 25. Стадии процесса 5. Диффузия. Молекулы продуктов реакции диффундируют с поверхности.
- 26. Сравнение типов катализа О сходстве механизмов гетерогенного и гомогенного катализа можно судить по тому, что стадия
- 27. Основные предпосылки к теории Стадии процесса: 1. Диффузия к поверхности. 2. Адсорбция (физическая и химическая) монослойная
- 28. Основные предпосылки к теории Стадии процесса: 1. Диффузия к поверхности при Т↑. 2. Адсорбция (физическая и
- 29. Основные предпосылки к теории Стадии процесса: 2. Адсорбция (физическая и химическая) монослойная или полислойная 3. Химическая
- 30. Закономерности обратимой хемосорбции молекул А kа АГ+ S ↔ (АS)адс , Θ = СAS/CASmax kд где
- 31. Кинетический закон действующих поверхностей: - скорость адсорбции пропорциональна числу столкновений молекул адсорбата (P) со свободными адсорбционными
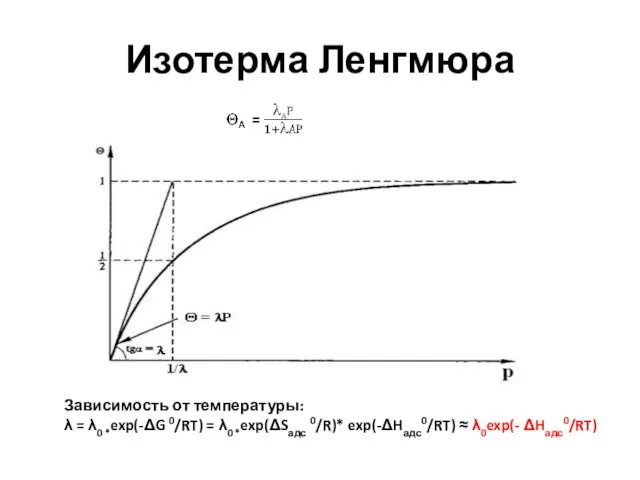
- 32. Изотерма Ленгмюра (1918 г)
- 33. Изотерма Ленгмюра Зависимость от температуры: λ = λ0 *exp(-ΔG 0/RT) = λ0 *exp(ΔSадс 0/R)* exp(-ΔHадс0/RT) ≈
- 34. Одновременная адсорбция нескольких газов (А и В)
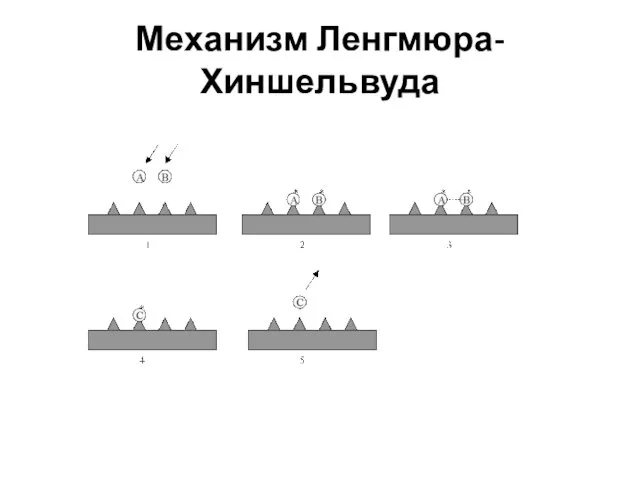
- 35. Механизм Ленгмюра-Хиншельвуда. 1921 г Он основан на следующих предположениях: Адсорбция мономолекулярная Реагент и продукт адсорбируются без
- 36. Механизм мономолекулярной гетерогенной реакции
- 37. Механизм Лэнгмюра-Хиншельвуда наблюдается для многих промышленных реакций:
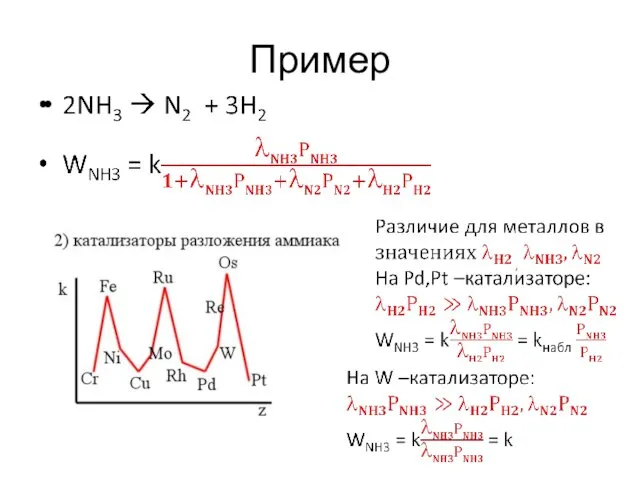
- 38. Пример
- 39. Пример Энергия активации Eа каталитических реакций значительно меньше, чем для той же реакций в отсутствие катализатора.
- 40. Примеры хемосорбционных процессов.
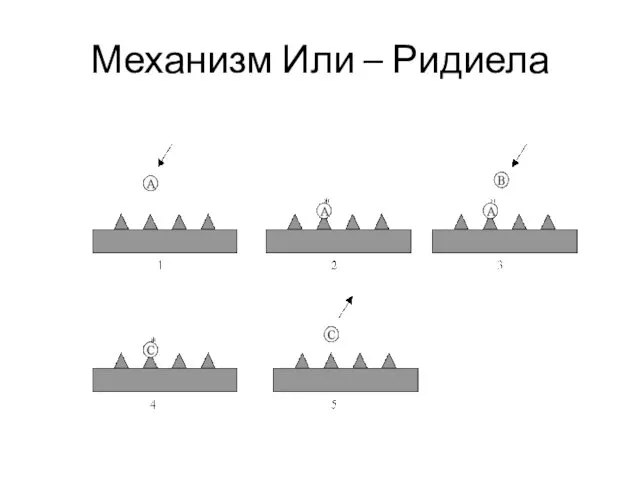
- 41. Механизмы гетерогенного катализа Различают два механизма: Механизм Ленгмюра-Хиншельвуда; Механизм Или – Ридиела
- 42. Механизм Ленгмюра-Хиншельвуда Рассмотрим каталитическую гетерогенную реакцию: А + В ?С kа,A kа,B АГ+ S ↔ (АS)адс
- 43. Механизм Ленгмюра-Хиншельвуда
- 44. Механизм Ленгмюра-Хиншельвуда
- 45. Механизм Или – Ридиела
- 46. Механизм Или – Ридиела (1941) Реакция осуществляется между адсорбированной молекулой (АS)адс и молекулой В в газовой
- 47. Механизм Или – Ридиела
- 48. Примеры по Или - Ридиелу
- 50. Скачать презентацию





































 Многоатомные спирты
Многоатомные спирты Энергетика химических реакций
Энергетика химических реакций Резиновая краска
Резиновая краска Перемешивание в жидких средах
Перемешивание в жидких средах «Уксусная кислота»
«Уксусная кислота»  Інтенсивні технології вирощування дрібнокісточкових культур
Інтенсивні технології вирощування дрібнокісточкових культур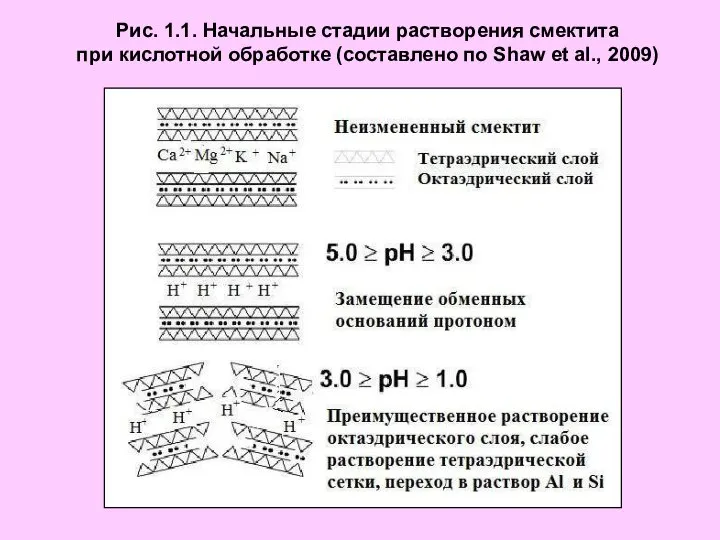 Начальные стадии растворения смектита при кислотной обработке
Начальные стадии растворения смектита при кислотной обработке Пифарнин (ribavirin)
Пифарнин (ribavirin) Динамический характер адсорбции. Лекция 2
Динамический характер адсорбции. Лекция 2 Физические и фазовые состояния полимеров
Физические и фазовые состояния полимеров Минеральные вещества
Минеральные вещества Вода: фізичні та хімічні властивості. Поширеність в природі
Вода: фізичні та хімічні властивості. Поширеність в природі Использование кислот природой и человеком
Использование кислот природой и человеком Электролиз. Задание № 20
Электролиз. Задание № 20 Магний. Электронное строение атома Mg
Магний. Электронное строение атома Mg Количество вещества
Количество вещества Газохимия. Абсорбционно-газофракционирующая установка. (Лекция 5.2)
Газохимия. Абсорбционно-газофракционирующая установка. (Лекция 5.2) Химическая кинетика. Лекция 2
Химическая кинетика. Лекция 2 Генетическая связь
Генетическая связь Группа рассеянных химических элементов
Группа рассеянных химических элементов Влияние условий хранения на качество лекарственных средств
Влияние условий хранения на качество лекарственных средств Презентация Биологическое действие радиации
Презентация Биологическое действие радиации  Органическая химия. Лекция. Стероиды
Органическая химия. Лекция. Стероиды Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Задача №9. Глицерин. Команда «Карбораны»
Задача №9. Глицерин. Команда «Карбораны» Нерівноважна термодинаміка та хімічна кінетика. Лекція 1
Нерівноважна термодинаміка та хімічна кінетика. Лекція 1 Физиология и биохимия бактерий. Дыхание и размножение микробов. Питание
Физиология и биохимия бактерий. Дыхание и размножение микробов. Питание Обзор основных методов исследования супрамолекулярных объектов
Обзор основных методов исследования супрамолекулярных объектов