Содержание
- 2. КИСЛОТНО-ОСНÓВНОЕ РАВНОВЕСИЕ Вода – слабый электролит и диссоциирует согласно уравнению: Константа диссоциации этого равновесия называется ионным
- 3. Диссоциация – эндотермический процесс => Kw растет с повышением температуры: По умолчанию температуру принимают равной 25
- 4. В щелочной среде: В соответствии с принципом Ле Шателье, при добавлении катионов водорода или гидроксид-ионов равновесие
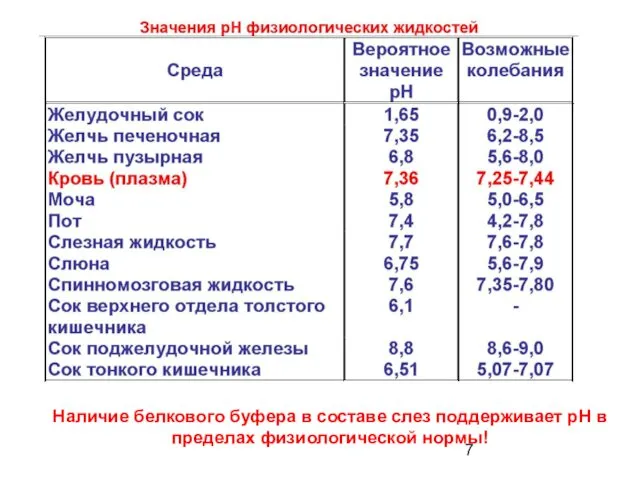
- 5. Для количественной характеристики среды раствора используют водородный и гидроксидный показатели. Водородный показатель pH («пэ-аш») – взятый
- 6. Для идеально чистой воды рН = 7 Дождевая вода имеет рН ≈ 5,5 – 6,0 за
- 7. Наличие белкового буфера в составе слез поддерживает рН в пределах физиологической нормы!
- 8. Расчет равновесных концентраций катионов водорода [H+] и гидроксид-ионов [OH–], рН и pOH в растворах кислот и
- 9. Найти [H+], рН, рОН, [OH-] в 0,005 М растворе H2SO4. 2. Раствор сильного основания M(OH)x (x
- 10. Найти [H+], рН, рОН, [OH−] в 0,03 М растворе KOH. 3. Раствор слабой кислоты, константа диссоциации
- 11. При c/Ka > 100 используют более простое уравнение: Найти [H+], рН, рОН, [OH−] в 0,3 М
- 12. 4. Раствор слабого основания, константа диссоциации которой равна Kb (если кислотность основания больше 1, то используется
- 13. При c/Kb > 100 используют более простое уравнение: Найти [H+], рН, рОН, [OH−] в 0,07 М
- 14. Найти [H+] и рН раствора, содержащего 0,2 моль/л HCOOH (Кa = 1,8∙10−4) и 0,1 моль/л CH3COOH
- 15. Найти [H+] и рН раствора, содержащего 0,05 моль/л (CH3)3NHOH (pКb = 4,20) и 0,03 моль/л CH3NH3OH
- 16. рН яблочного сока равен 4,57. Найти [Н+] и [OH−] (моль/л). Для растворов сильных электролитов с достаточно
- 17. Активная, потенциальная и общая кислотность (щелочность) раствора. Активная кислотность [H+]акт – концентрация свободных ионов Н+, имеющихся
- 18. Найти [H+]акт, [H+]пот и [H+]общ в 0,05 М растворе H2SO4. Найти [H+]акт, [H+]пот и [H+]общ в
- 19. Найти [OH–]акт, [OH–]пот и [OH–]общ в 0,04 М растворе (CH3)3NHOH (Кb = 6,3∙10–5). Найти [OH–]акт, [OH–]пот
- 21. Скачать презентацию





![Расчет равновесных концентраций катионов водорода [H+] и гидроксид-ионов [OH–], рН и](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/447407/slide-7.jpg)
![Найти [H+], рН, рОН, [OH-] в 0,005 М растворе H2SO4. 2.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/447407/slide-8.jpg)
![Найти [H+], рН, рОН, [OH−] в 0,03 М растворе KOH. 3.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/447407/slide-9.jpg)
![При c/Ka > 100 используют более простое уравнение: Найти [H+], рН,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/447407/slide-10.jpg)

![При c/Kb > 100 используют более простое уравнение: Найти [H+], рН,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/447407/slide-12.jpg)
![Найти [H+] и рН раствора, содержащего 0,2 моль/л HCOOH (Кa =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/447407/slide-13.jpg)
![Найти [H+] и рН раствора, содержащего 0,05 моль/л (CH3)3NHOH (pКb =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/447407/slide-14.jpg)
![рН яблочного сока равен 4,57. Найти [Н+] и [OH−] (моль/л). Для](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/447407/slide-15.jpg)
![Активная, потенциальная и общая кислотность (щелочность) раствора. Активная кислотность [H+]акт –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/447407/slide-16.jpg)
![Найти [H+]акт, [H+]пот и [H+]общ в 0,05 М растворе H2SO4. Найти](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/447407/slide-17.jpg)
![Найти [OH–]акт, [OH–]пот и [OH–]общ в 0,04 М растворе (CH3)3NHOH (Кb](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/447407/slide-18.jpg)
 The phenomenon of radioactivity. Radioisotopes. The nuclear reaction
The phenomenon of radioactivity. Radioisotopes. The nuclear reaction Получение спиртов. Применение
Получение спиртов. Применение Основные кинетические характеристики процесса обратноосмотической очистки сточных вод гальванопроизводств
Основные кинетические характеристики процесса обратноосмотической очистки сточных вод гальванопроизводств Работу выполнила Ученица 11 «Т» класса Лицея № 35 Аранина Елена.
Работу выполнила Ученица 11 «Т» класса Лицея № 35 Аранина Елена. Материаловедение. Строение и основные свойства металлов
Материаловедение. Строение и основные свойства металлов «Розчини»
«Розчини»  Gmp – тиісті өндірістік тәжірибе
Gmp – тиісті өндірістік тәжірибе Геохимия рудных месторождений
Геохимия рудных месторождений Микроколичественное определение 2,3-бутандиола для анализа антирадикальной активности фенольных соединений
Микроколичественное определение 2,3-бутандиола для анализа антирадикальной активности фенольных соединений Химическая музыка
Химическая музыка Химии ни коим образом научиться невозможно, не видав самой практики и не принимаясь за химические операции
Химии ни коим образом научиться невозможно, не видав самой практики и не принимаясь за химические операции Железо Fe
Железо Fe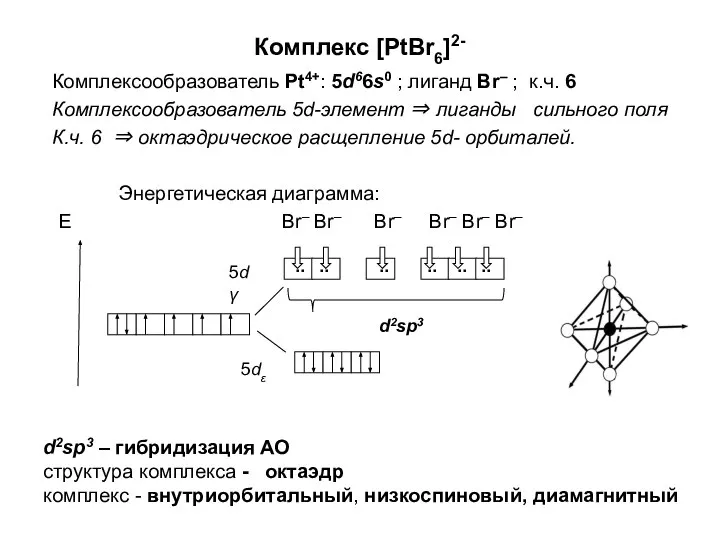 Комплексообразователь. (Лекция 5)
Комплексообразователь. (Лекция 5) Презентация по Химии "РАДИОИЗОТОПНЫЙ КОМПЛЕКС РИЦ-80. РАЗРАБОТКА НОВЫХ МЕТОДОВ ПОЛУЧЕНИЯ ГЕНЕРАТОРНОГО ИЗОТОПА Sr-82 И ДРУГИХ МЕДИ
Презентация по Химии "РАДИОИЗОТОПНЫЙ КОМПЛЕКС РИЦ-80. РАЗРАБОТКА НОВЫХ МЕТОДОВ ПОЛУЧЕНИЯ ГЕНЕРАТОРНОГО ИЗОТОПА Sr-82 И ДРУГИХ МЕДИ Классификация органических соединений
Классификация органических соединений Магнитодиэлектрический эффект в нанокристаллическом мультиферроике BiFeO3
Магнитодиэлектрический эффект в нанокристаллическом мультиферроике BiFeO3 Карбонаты и фосфаты
Карбонаты и фосфаты В мире кислот Автор: Бухтеева Елена учащаяся 8 «В» класса, МОУ Голицынская СОШ №1 Руководитель: Маланина Елена Алексеевна учител
В мире кислот Автор: Бухтеева Елена учащаяся 8 «В» класса, МОУ Голицынская СОШ №1 Руководитель: Маланина Елена Алексеевна учител Тема урока : Скорость химической реакции
Тема урока : Скорость химической реакции  Композиционные или композитные материалы
Композиционные или композитные материалы Классификация неорганических веществ
Классификация неорганических веществ Кремний
Кремний Углерод. Соединения углерода
Углерод. Соединения углерода Галогенопроизводные и их общая формула
Галогенопроизводные и их общая формула Презентация по химии ПЕПТИДЫ и Белки
Презентация по химии ПЕПТИДЫ и Белки  Щелочные металлы. (9 класс)
Щелочные металлы. (9 класс) Липиды (жиры)
Липиды (жиры) Каталитический крекинг
Каталитический крекинг