Содержание
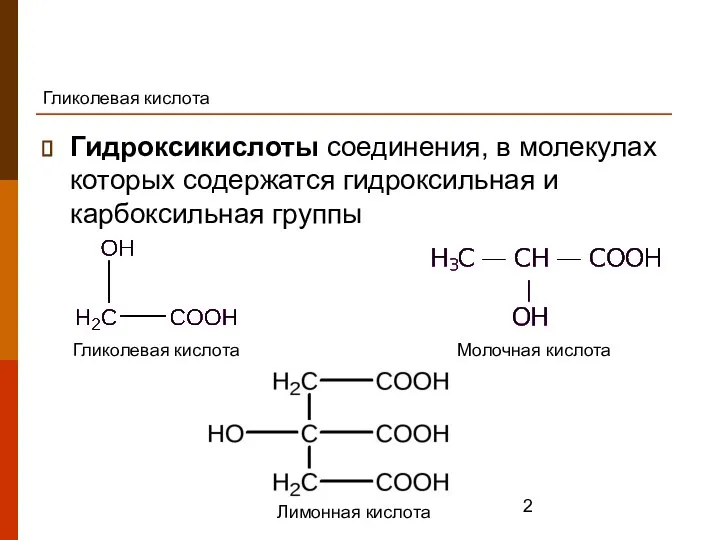
- 2. Гликолевая кислота Гидроксикислоты соединения, в молекулах которых содержатся гидроксильная и карбоксильная группы Гликолевая кислота Молочная кислота
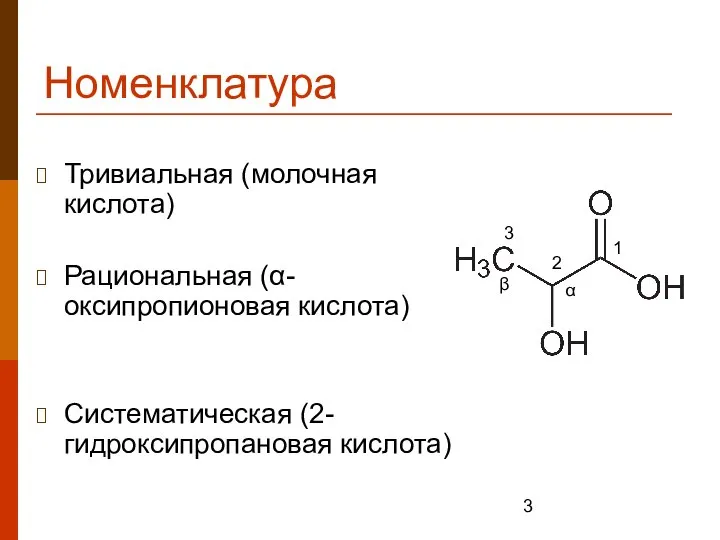
- 3. Номенклатура Тривиальная (молочная кислота) Рациональная (α-оксипропионовая кислота) Систематическая (2-гидроксипропановая кислота) α β 1 2 3
- 4. Изомерия Структурная: изомерия углеродного скелета изомерия взаимного расположения функциональных групп
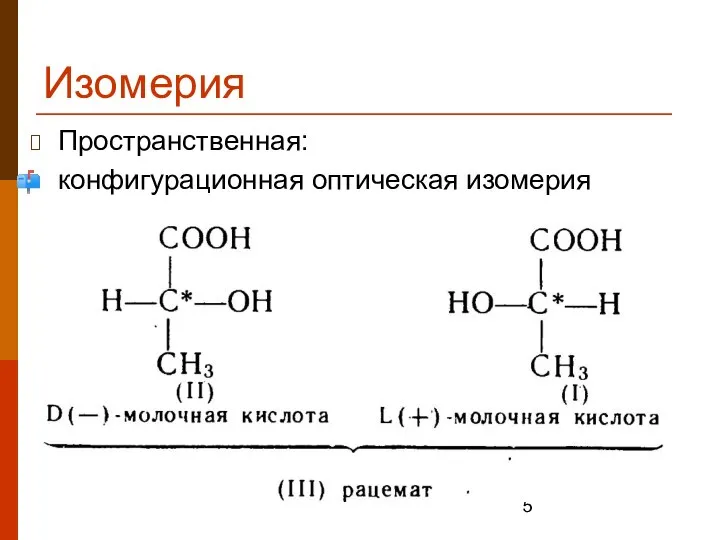
- 5. Изомерия Пространственная: конфигурационная оптическая изомерия
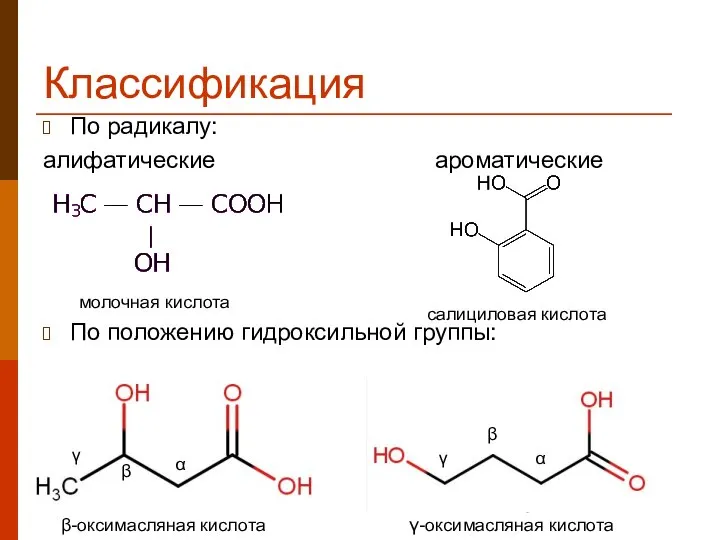
- 6. Классификация По радикалу: алифатические ароматические По положению гидроксильной группы: молочная кислота салициловая кислота β-оксимасляная кислота α
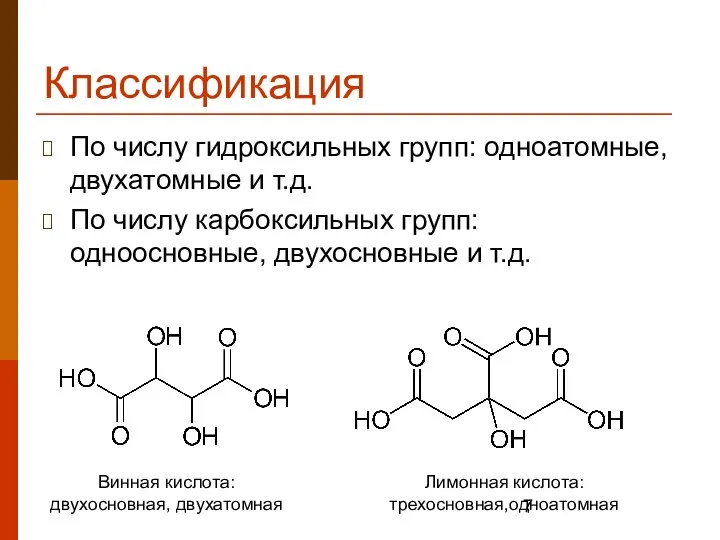
- 7. Классификация По числу гидроксильных групп: одноатомные, двухатомные и т.д. По числу карбоксильных групп: одноосновные, двухосновные и
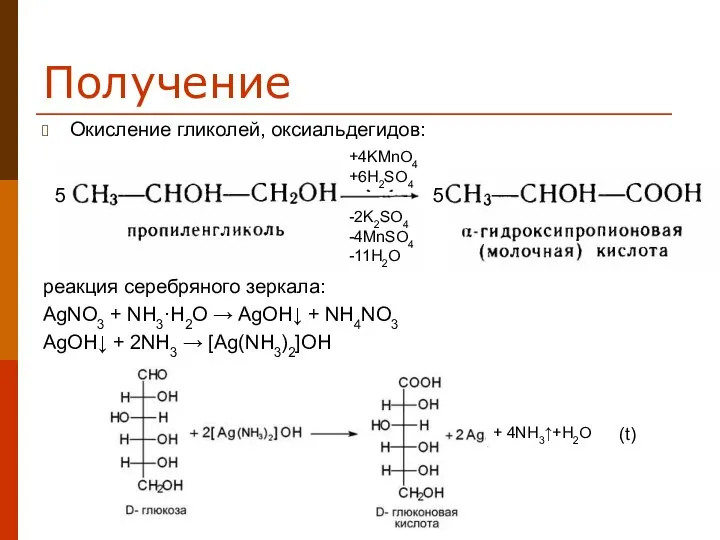
- 8. Получение Окисление гликолей, оксиальдегидов: реакция серебряного зеркала: AgNO3 + NH3·H2O → AgOH↓ + NH4NO3 AgOH↓ +
- 9. Получение Гидролиз галогенпроизводных карбоновых кислот:
- 10. Получение Цианогидринный способ: [H+] δ- δ+ δ- δ+
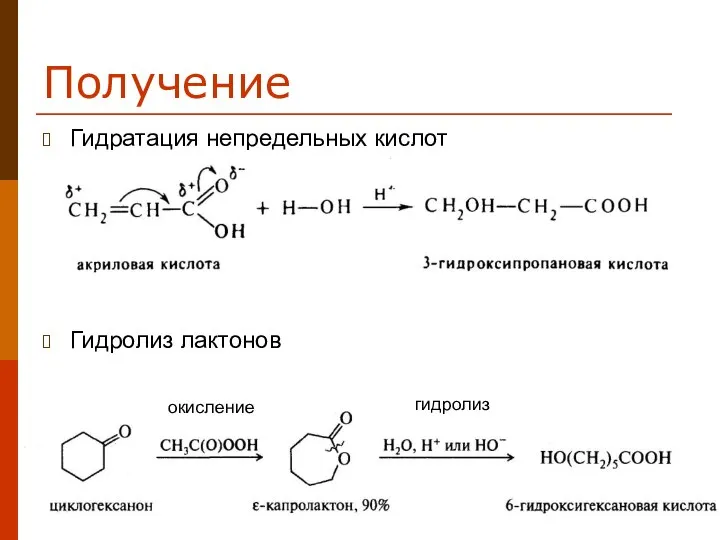
- 11. Получение Гидратация непредельных кислот Гидролиз лактонов окисление гидролиз
- 12. Получение Окисление ненасыщенных кислот в мягких условиях Гидрирование оксокислот 4H2O -2MnO2 -2KOH 3 2 3 2[H]
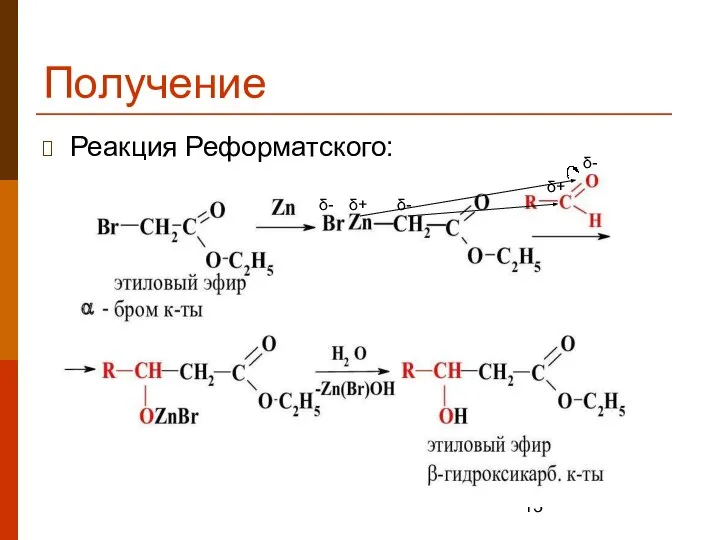
- 13. Получение Реакция Реформатского: δ- δ+ δ- δ- δ+
- 14. Физические свойства Одноосновные гидроксикислоты – сиропообразые или твердые вещества Двухосновные гидроксикислоты – твердые кристаллические соединения tпл,
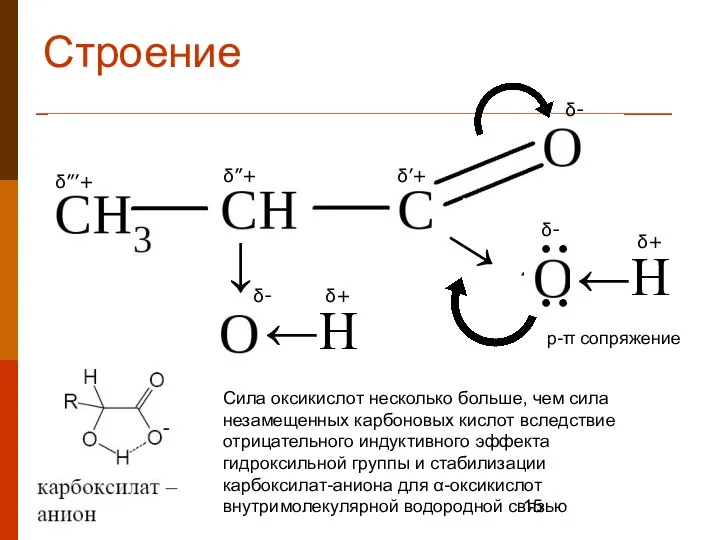
- 15. Строение ←Н ←Н → → ● ● ● ● δ- δ’+ δ- δ- δ+ δ+ δ”’+
- 16. Значения констант кислотности некоторых карбоновых и гидроксикарбоновых кислот
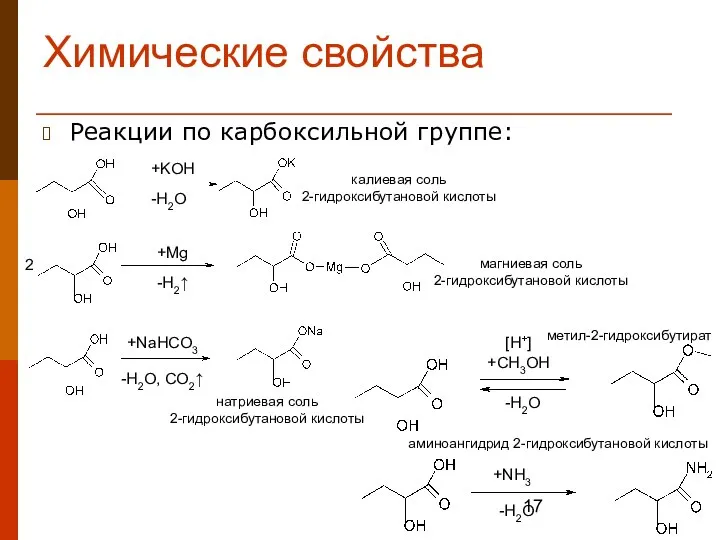
- 17. Химические свойства Реакции по карбоксильной группе: 2 +KOH -H2O +Mg -H2↑ +NaHCO3 -H2O, CO2↑ [H+] +CH3OH
- 18. Химические свойства Реакции по гидроксильной группе: [H+] -H2O +HCl -H2O + 2-хлорпентановая кислота О-бутирил-α-оксивалериановая кислота
- 19. Химические свойства [O] + -CH3COOH α-оксовалериановая кислота О-ацетил-α-оксивалериановая кислота -H2O
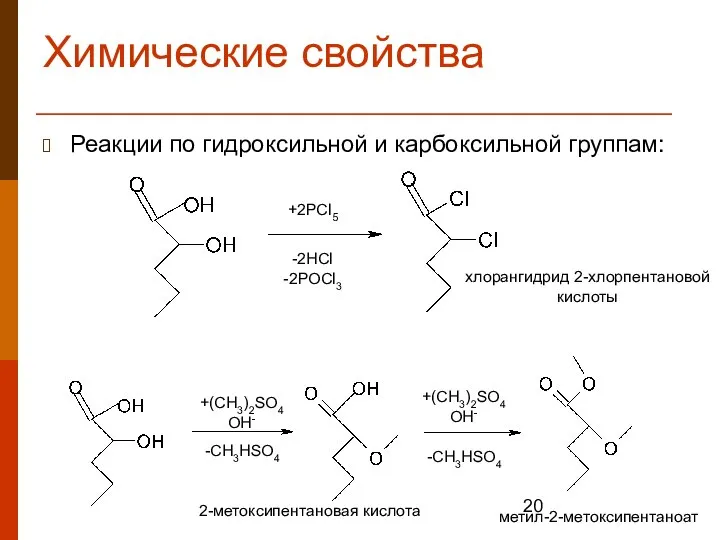
- 20. Химические свойства Реакции по гидроксильной и карбоксильной группам: +2PCl5 -2HCl -2POCl3 +(CH3)2SO4 OH- -CH3HSO4 +(CH3)2SO4 OH-
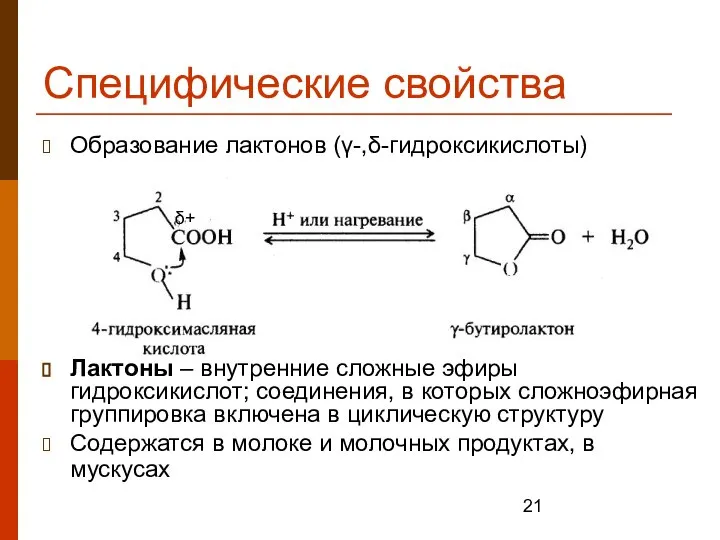
- 21. Специфические свойства Образование лактонов (γ-,δ-гидроксикислоты) Лактоны – внутренние сложные эфиры гидроксикислот; соединения, в которых сложноэфирная группировка
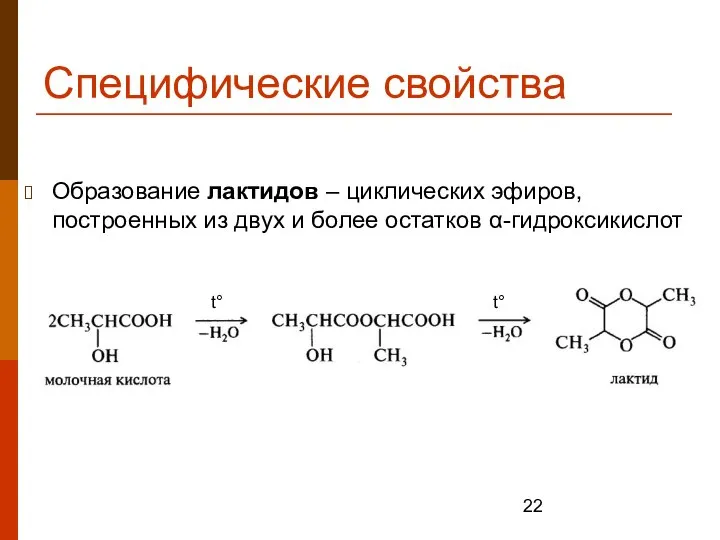
- 22. Специфические свойства Образование лактидов – циклических эфиров, построенных из двух и более остатков α-гидроксикислот t° t°
- 23. Специфические свойства Реакции элиминирования (β-гидрокислоты): Кипячение α-гидроксикислот с минеральными кислотами t°
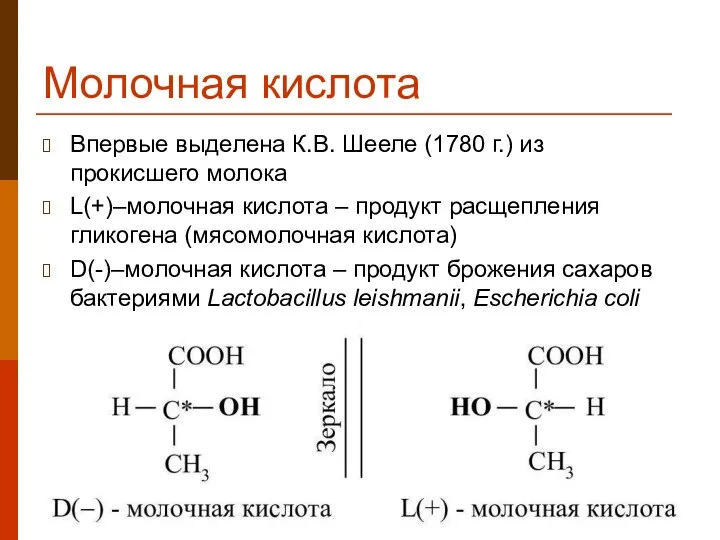
- 24. Молочная кислота Впервые выделена К.В. Шееле (1780 г.) из прокисшего молока L(+)–молочная кислота – продукт расщепления
- 25. Применение молочной кислоты Пищевая добавка для подкисления, консервирования, регулирования рН, улучшения вкуса, запаха, структуры продуктов Животноводческая
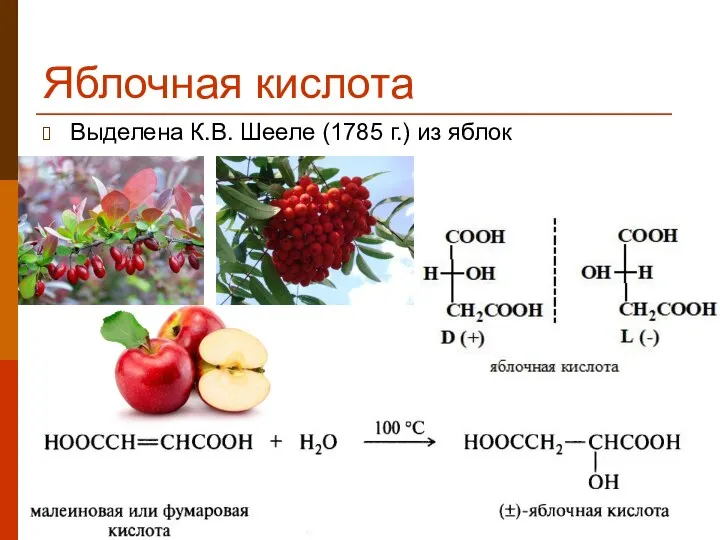
- 26. Яблочная кислота Выделена К.В. Шееле (1785 г.) из яблок
- 27. Вальденовское обращение 1896 г. SN2 SN2 SN1 SN1
- 28. Применение яблочной кислоты Пищевая добавка: регулятор кислотности, стабилизатор, вкусовой агент при производстве прохладительных напитков, мармелада и
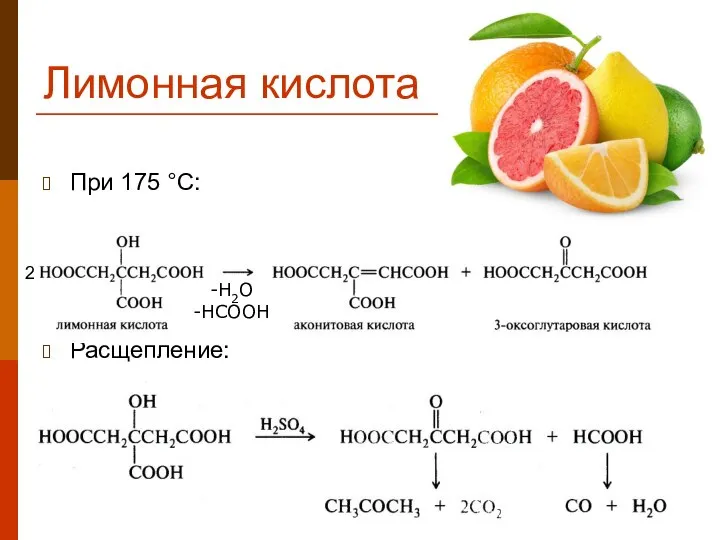
- 29. Лимонная кислота При 175 °С: Расщепление: -H2O -HCOOH 2
- 30. Применение лимонной кислоты Пищевая промышленность: вкусовая добавка, консервант и регулятор кислотности в производстве плавленых сыров, напитков,
- 31. Винная кислота D(+)-винная (виннокаменная) кислота, встречается в винограде L(-)-винная кислота образуется при расщеплении виноградной кислоты
- 32. Применение винной кислоты Пищевая промышленность: консервант и подкислитель Косметология: в составе кремов и лосьонов для лица
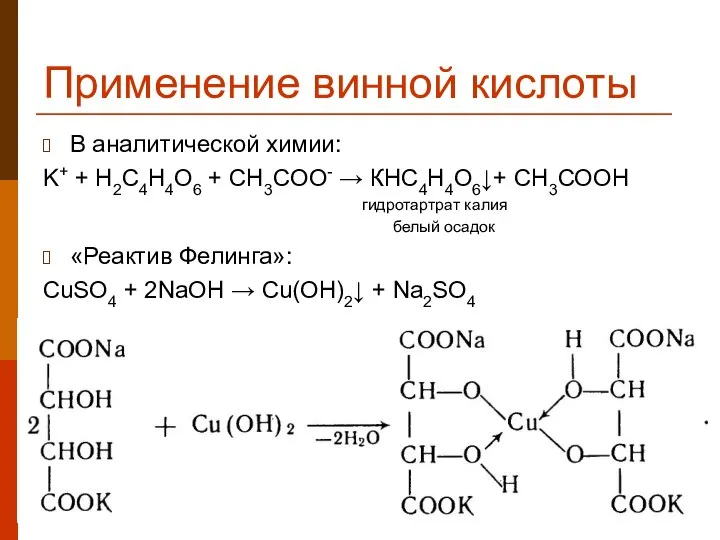
- 33. Применение винной кислоты В аналитической химии: K+ + H2C4H4O6 + CH3COO- → КНС4Н4О6↓+ СН3СООН гидротартрат калия
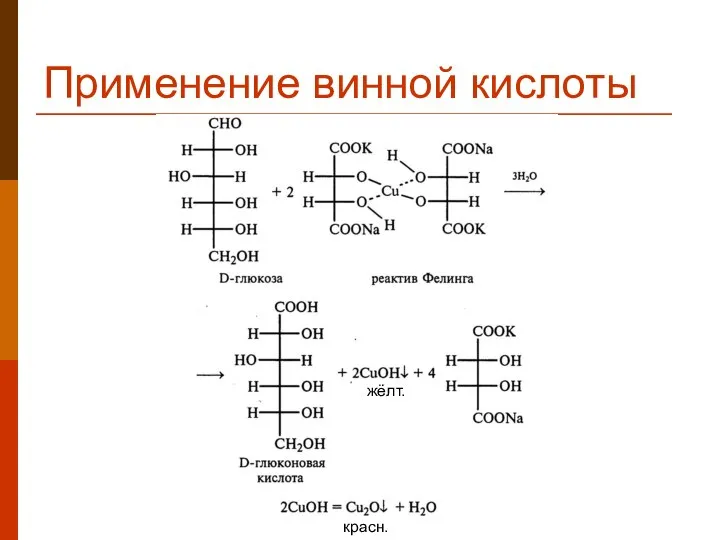
- 34. Применение винной кислоты жёлт. красн.
- 35. Разделение рацематов на антиподы Самопроизвольное расщепление при кристаллизации t > 28°C – кристаллы соли виноградной кислоты
- 36. Разделение рацематов на антиподы Биохимическое расщепление Связано с высокой стереохимической специфичностью ферментов микроорганизмов Плесневелый грибок Penicillium
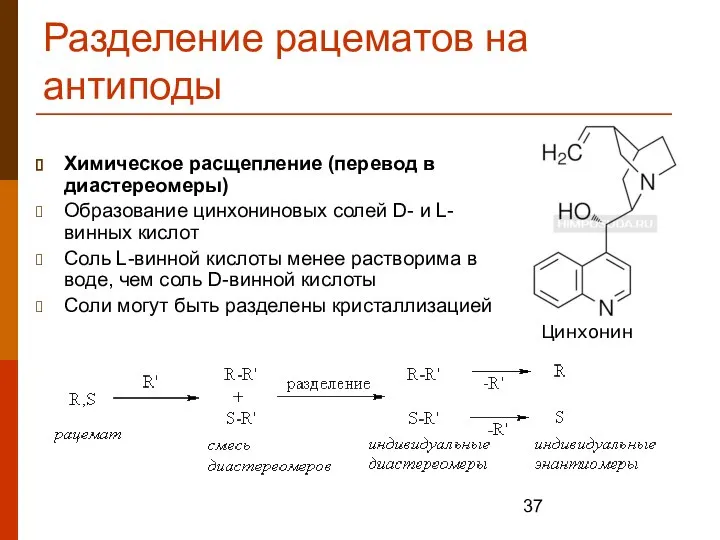
- 37. Разделение рацематов на антиподы Химическое расщепление (перевод в диастереомеры) Образование цинхониновых солей D- и L-винных кислот
- 38. Разделение рацематов на антиподы Хроматографическое распределение В основе лежит способность хиральных агентов или селекторов предпочтительно взаимодействовать
- 40. Скачать презентацию


![Получение Цианогидринный способ: [H+] δ- δ+ δ- δ+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/706664/slide-9.jpg)
![Получение Окисление ненасыщенных кислот в мягких условиях Гидрирование оксокислот 4H2O -2MnO2 -2KOH 3 2 3 2[H]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/706664/slide-11.jpg)


![Химические свойства Реакции по гидроксильной группе: [H+] -H2O +HCl -H2O + 2-хлорпентановая кислота О-бутирил-α-оксивалериановая кислота](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/706664/slide-17.jpg)
![Химические свойства [O] + -CH3COOH α-оксовалериановая кислота О-ацетил-α-оксивалериановая кислота -H2O](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/706664/slide-18.jpg)










 Презентация по Химии "Органічні сполуки і здоров’я людини." - скачать смотреть бесплатно
Презентация по Химии "Органічні сполуки і здоров’я людини." - скачать смотреть бесплатно Химическая связь
Химическая связь Використання кислот в будівництві і побуті. 8 клас
Використання кислот в будівництві і побуті. 8 клас Способи добування алкінів Презентація Учениці 11-А класу Гаджук Зорини
Способи добування алкінів Презентація Учениці 11-А класу Гаджук Зорини  Круговорот азота в природе
Круговорот азота в природе Предел упругости
Предел упругости Сульфаттар және эфирсульфаттар
Сульфаттар және эфирсульфаттар Загальна характеристика неметалічних елементів. Неметали як прості речовини. Явище алотропії, алотропні видозміни Оксигену і
Загальна характеристика неметалічних елементів. Неметали як прості речовини. Явище алотропії, алотропні видозміни Оксигену і Волокна Презентація на тему:
Волокна Презентація на тему:  Кристаллические решетки
Кристаллические решетки Презентація на тему: Каучуки Виконав: Учень 11-Б класу Путьо Михайло
Презентація на тему: Каучуки Виконав: Учень 11-Б класу Путьо Михайло  Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) 6-членные гетероциклы с одним гетероатомом
6-членные гетероциклы с одним гетероатомом Презентация по Химии "СИММЕТРИЯ В ХИМИИ" - скачать смотреть
Презентация по Химии "СИММЕТРИЯ В ХИМИИ" - скачать смотреть  Химия тория и протактиния
Химия тория и протактиния Степень диссоциации. 9 класс
Степень диссоциации. 9 класс Физические и химические явления
Физические и химические явления Синтез метилового эфира цинкофорина
Синтез метилового эфира цинкофорина Белки. Функции белков
Белки. Функции белков Виды изомерии. Углеводороды
Виды изомерии. Углеводороды Lead
Lead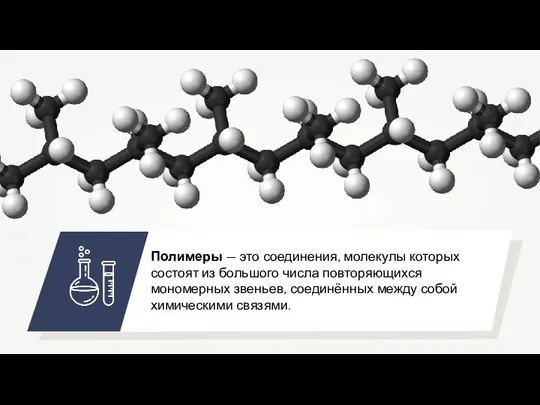 Органические и неорганические полимеры
Органические и неорганические полимеры Основные классы неорганических веществ
Основные классы неорганических веществ Над проектом работали ученики 6 класса: Над проектом работали ученики 6 класса: Крючков Слава Орлов Слава Старова Катя Пугачев Се
Над проектом работали ученики 6 класса: Над проектом работали ученики 6 класса: Крючков Слава Орлов Слава Старова Катя Пугачев Се 8 класс (обязательный минимум по химии) Теория электролитической диссоциации (ТЭД). Урок 1
8 класс (обязательный минимум по химии) Теория электролитической диссоциации (ТЭД). Урок 1 Подготовка учащихся к выполнению заданий различного уровня сложности ЕГЭ по химии
Подготовка учащихся к выполнению заданий различного уровня сложности ЕГЭ по химии Мир химических элементов
Мир химических элементов Адам ағзасындағы химиялық элементтер
Адам ағзасындағы химиялық элементтер