Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева (урок 1 - 2)
Содержание
- 2. 1) положение (Аr№Э – период (большой или малый), группа, подгруппа). 2) состав атома (z, p+, ē
- 3. 4) сравнить свойства элемента с соседями по подгруппе и периоду Период →Ме↓, неМе↑, радиус атома ↓
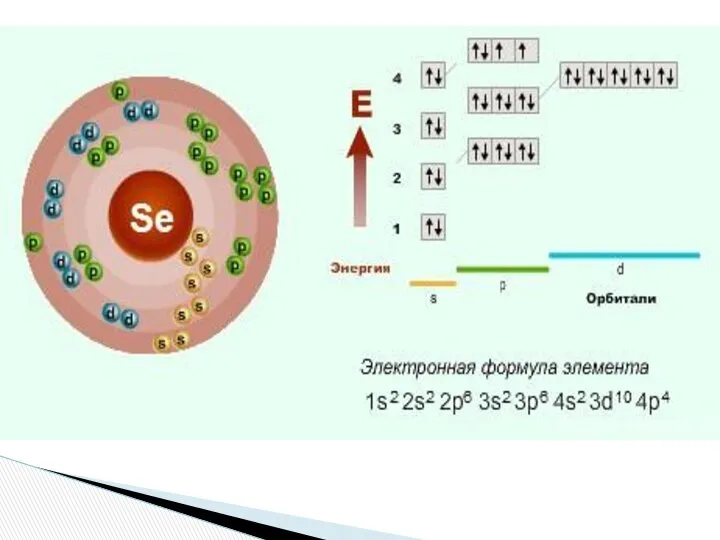
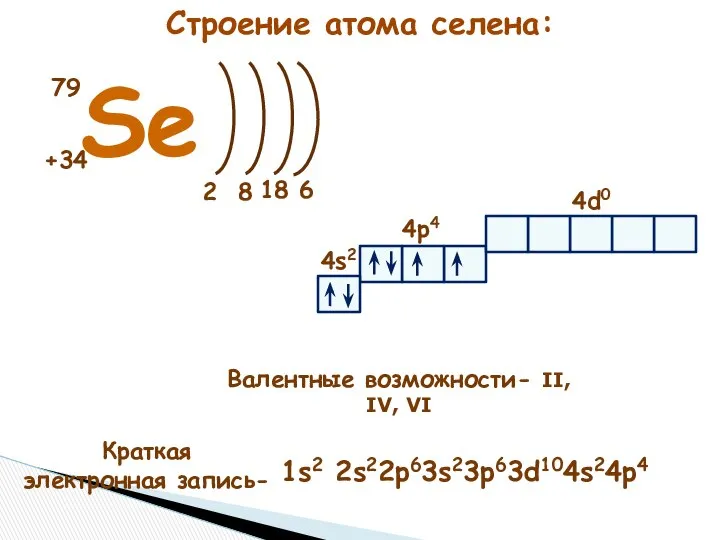
- 4. 1) Селен - 3479Sе Период – 4, VI группа, главная подгруппа 2) z=+34, p+=34, n=79–34=45, ē
- 6. 4) Неметаллические свойства у селена выражены сильнее, чем у теллура и мышьяка, но слабее, чем у
- 7. Se +34 79 2 6 8 4s2 4p4 4d0 Краткая электронная запись- Валентные возможности- II, IV,
- 9. Скачать презентацию




 Аминокислоты. Классификация аминокислот
Аминокислоты. Классификация аминокислот What is enthalpy?
What is enthalpy? Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений
Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений Колебания кристаллической решетки и ее тепловые свойства. Динамика решетки
Колебания кристаллической решетки и ее тепловые свойства. Динамика решетки Нитраты в овощах и фруктах
Нитраты в овощах и фруктах Магнитные свойства твердых тел
Магнитные свойства твердых тел Сырьё для получения фенолальдегидных полимеров
Сырьё для получения фенолальдегидных полимеров Гормоны щитовидной и поджелудочной желез. (Лекция 13)
Гормоны щитовидной и поджелудочной желез. (Лекция 13) Особенности строения, реакционной способности и методы синтеза алкенов
Особенности строения, реакционной способности и методы синтеза алкенов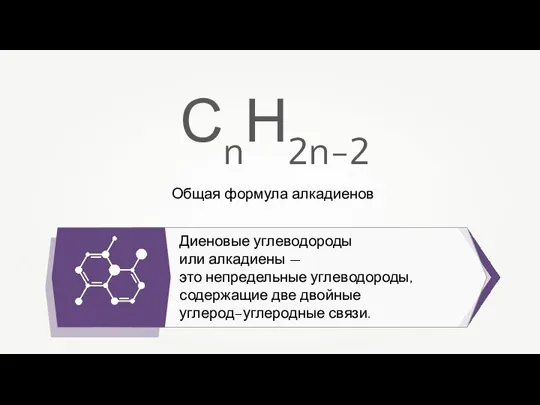 Общая формула алкадиенов
Общая формула алкадиенов Потенциодинамическая электрохимическая наногравиметрия теллура и его соединений
Потенциодинамическая электрохимическая наногравиметрия теллура и его соединений Материаловедение. Адсорбционные материалы. Металлоорганические каркасы
Материаловедение. Адсорбционные материалы. Металлоорганические каркасы Углеводороды: номенклатура
Углеводороды: номенклатура Алканы. Пропан
Алканы. Пропан Изучение десорбции лантаноидов и иттирия из сульфокатионита КУ-2 с применением сульфата аммония
Изучение десорбции лантаноидов и иттирия из сульфокатионита КУ-2 с применением сульфата аммония Строение, изомерия, физические и химические свойства алкенов. Способы получения алкенов. Применение
Строение, изомерия, физические и химические свойства алкенов. Способы получения алкенов. Применение Методы выделения, очистки, идентификации и изучения мембранных структур
Методы выделения, очистки, идентификации и изучения мембранных структур Реакции ионного обмена
Реакции ионного обмена Металдар мен бейметалдар, олардың қосылыстарының қасиеттерінің период және топ бойынша өзгеруі
Металдар мен бейметалдар, олардың қосылыстарының қасиеттерінің период және топ бойынша өзгеруі Плотность нефти и нефтепродуктов
Плотность нефти и нефтепродуктов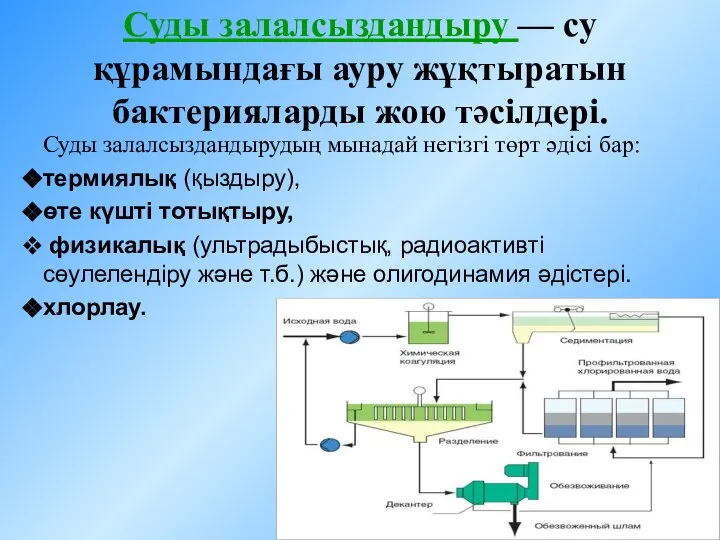 Суды залалсыздандыру - су құрамындағы ауру жұқтыратын бактерияларды жою тәсілдері
Суды залалсыздандыру - су құрамындағы ауру жұқтыратын бактерияларды жою тәсілдері Углеводороды и их природные источники. Гомологический ряд алканов. Строение алканов
Углеводороды и их природные источники. Гомологический ряд алканов. Строение алканов Химические свойства многоатомных спиртов
Химические свойства многоатомных спиртов Химическая термодинамика
Химическая термодинамика Любовь, что движет Солнце и Светила Интегрированный урок по химии и литературе Подготовили: учитель химии Акимова О.В.
Любовь, что движет Солнце и Светила Интегрированный урок по химии и литературе Подготовили: учитель химии Акимова О.В.  Изучение стереохимии циклических формалей глицерина методом ЯМР-спектроскопии
Изучение стереохимии циклических формалей глицерина методом ЯМР-спектроскопии Химический состав клетки. Нуклеиновые кислоты. ДНК. РНК, АТФ
Химический состав клетки. Нуклеиновые кислоты. ДНК. РНК, АТФ Пятичленные гетероциклические соединения. Профильный уровень
Пятичленные гетероциклические соединения. Профильный уровень