Содержание
- 2. Реакции между ионами называют ионными реакциями, а уравнения таких реакций – ионными уравнениями. Большинство химических реакций
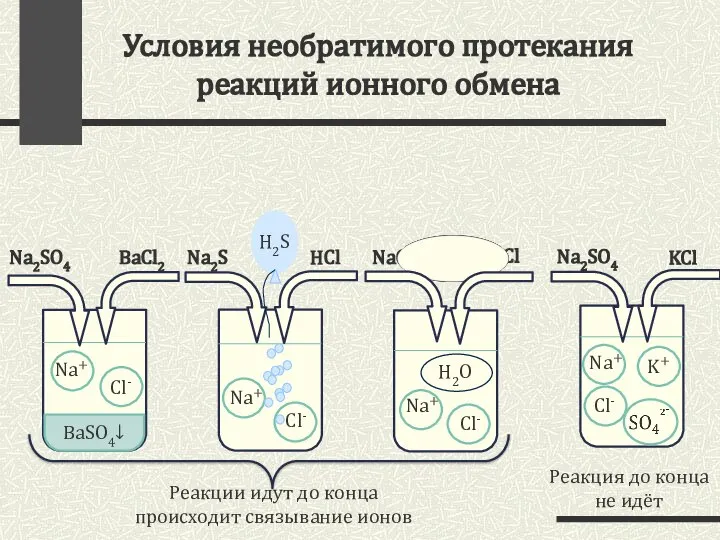
- 3. Условия необратимого протекания реакций ионного обмена Na2SO4 KCl Na2SO4 BaCl2 Реакция до конца не идёт Na2S
- 4. Условия реакций ионного обмена: 1) Растворимость реагирующих веществ: Кислота + Основание. Растворим хотя бы 1 из
- 5. Правила составления ионных уравнений При составлении ионных уравнений следует руководствоваться тем, что вещества малодиссоциирующие, нерастворимые и
- 6. Правила составления РИО: Простые вещества, оксиды, а также нерастворимые кислоты, основания и соли на ионы не
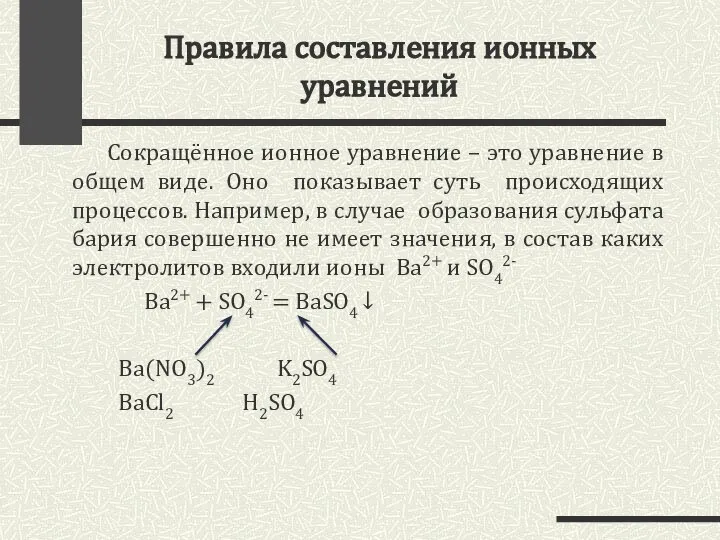
- 7. Правила составления ионных уравнений Сокращённое ионное уравнение – это уравнение в общем виде. Оно показывает суть
- 8. Правила составления ионных уравнений
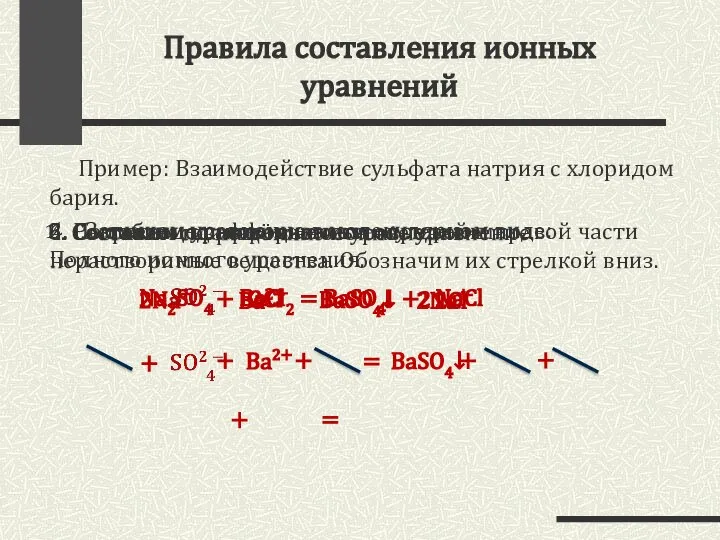
- 9. Правила составления ионных уравнений Пример: Взаимодействие сульфата натрия с хлоридом бария. Запишем уравнение в молекулярном виде:
- 10. Примеры реакций ионного обмена Молекулярное уравнение реакции щелочи с кислотой: КOH + HCl = KCl +
- 11. Примеры реакций ионного обмена Молекулярное уравнение реакции основного оксида с кислотой: CaO + 2HNO3 = Ca(NO3)2
- 12. Примеры реакций ионного обмена Молекулярное уравнение реакции нерастворимого основания с кислотой: 3Mg(OH)2 + 2H3PO4 = Mg3(PO4)2
- 13. Примеры реакций ионного обмена Молекулярное уравнение реакции амфотерного оксида с кислотой: Al2O3 + 6HCl = 2AlCl3
- 14. Примеры реакций ионного обмена Молекулярное уравнение реакции растворимой соли со щелочью: CuCl2 + 2KOH = 2KCl
- 15. Примеры реакций ионного обмена
- 16. Примеры реакций ионного обмена Молекулярное уравнение реакции растворимой соли (сульфида) с кислотой: K2S + 2HCl =
- 17. Примеры реакций ионного обмена
- 18. Примеры реакций ионного обмена
- 20. Скачать презентацию














 Химические реакторы
Химические реакторы Презентация по Химии "Классификация углеводов" - скачать смотреть
Презентация по Химии "Классификация углеводов" - скачать смотреть  Аттестационная работа. Проектно - исследовательская технология, как способ формирования УУД по химии
Аттестационная работа. Проектно - исследовательская технология, как способ формирования УУД по химии Қатты күйдегі препараттар
Қатты күйдегі препараттар Термодинамические возможности получения меди с применением программного комплекса АСТРА-4
Термодинамические возможности получения меди с применением программного комплекса АСТРА-4 Топливо. Механические топки
Топливо. Механические топки Лекция 10. Химия s-элементов
Лекция 10. Химия s-элементов Чистые вещества и смеси
Чистые вещества и смеси Роль хімічних знань у пізнанні природи
Роль хімічних знань у пізнанні природи Кинетика химических реакций. Химическое равновесие
Кинетика химических реакций. Химическое равновесие Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Основы кристаллического строения. Лекция 1
Основы кристаллического строения. Лекция 1 Информационное письмо для студентов дистанционного обучения фармацевтического факультета по дисциплине Аналитическая химия
Информационное письмо для студентов дистанционного обучения фармацевтического факультета по дисциплине Аналитическая химия Скорость химических реакций
Скорость химических реакций Щелочные металлы
Щелочные металлы Предмет и задачи химии
Предмет и задачи химии Металлдардың кристалдық құрылымы
Металлдардың кристалдық құрылымы Физические и химические свойства кислот.
Физические и химические свойства кислот. Конструкционные полимеры: классификация, достижения и проблемы
Конструкционные полимеры: классификация, достижения и проблемы Йод. Йодтың ашылуы
Йод. Йодтың ашылуы Сравнение и выбор типа реактора
Сравнение и выбор типа реактора Поширення та колообіг оксигену в природі
Поширення та колообіг оксигену в природі Презентация по химии Органические вещества
Презентация по химии Органические вещества  Пластификаторы и пластификация полимеров
Пластификаторы и пластификация полимеров Производные углеводородов
Производные углеводородов Судың кермектілігі. Сілтілік металдар мен сілтілікжер металдардың табиғи қосылыстарының қазақстандағы кен орындары
Судың кермектілігі. Сілтілік металдар мен сілтілікжер металдардың табиғи қосылыстарының қазақстандағы кен орындары Электронное состояние атомов азота в азотсодержащих углеродных нанотрубках
Электронное состояние атомов азота в азотсодержащих углеродных нанотрубках Витамины и коферменты
Витамины и коферменты