Содержание
- 2. ХИМИЧЕСКАЯ СВЯЗЬ совокупность сил, обуславливающих взаимодействие атомов в химических соединениях
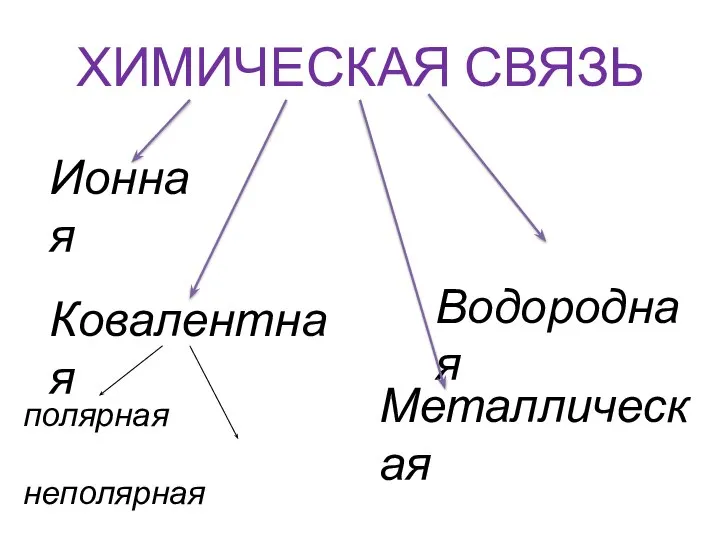
- 3. ХИМИЧЕСКАЯ СВЯЗЬ полярная неполярная Ионная Ковалентная Металлическая Водородная
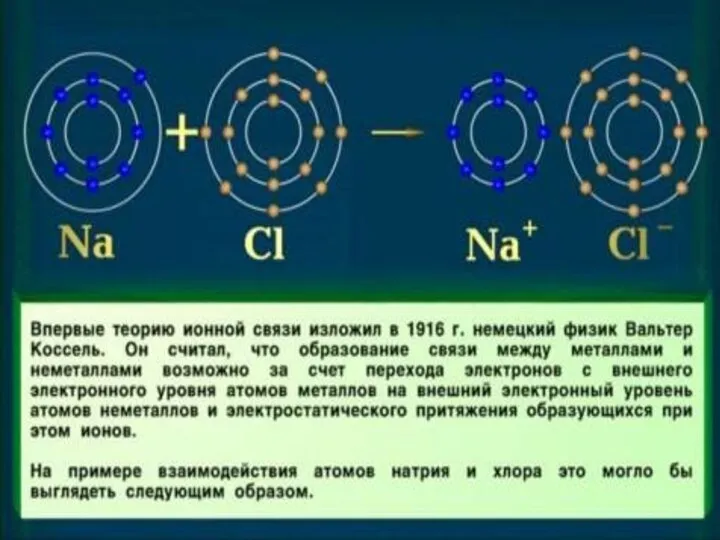
- 5. Ионная связь Связь, образовавшаяся между катионами и анионами за счет их электростатического притяжения
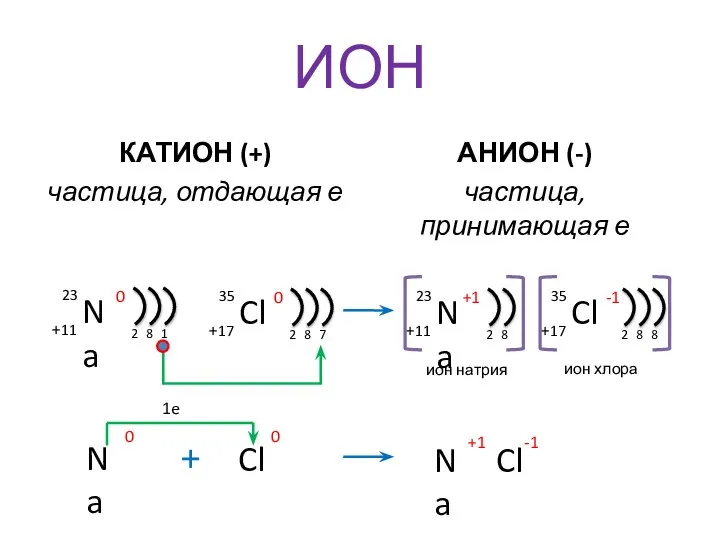
- 6. ИОН КАТИОН (+) частица, отдающая е АНИОН (-) частица, принимающая е 1e
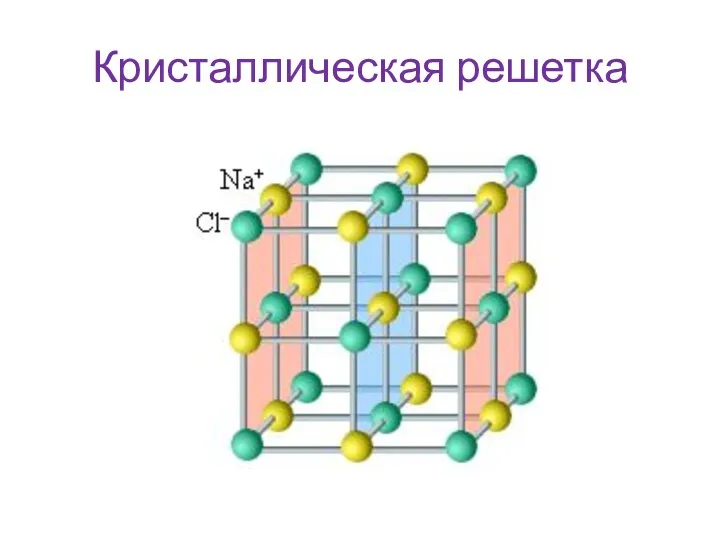
- 8. Кристаллическая решетка
- 9. Ионные соединения в природе
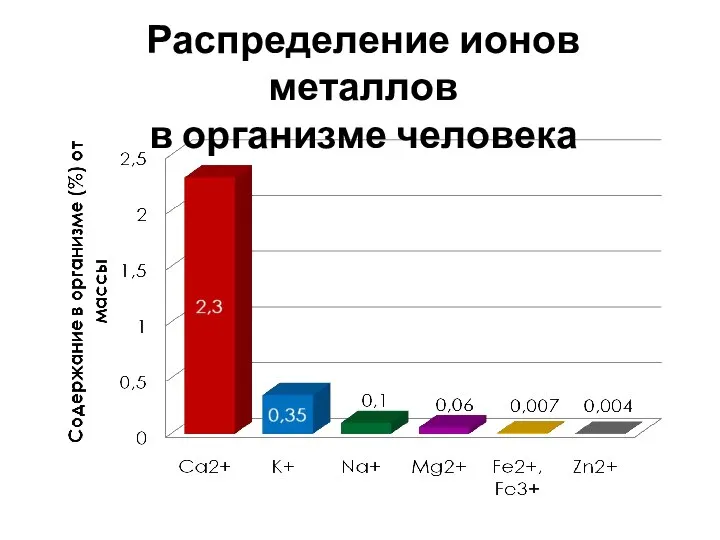
- 10. Распределение ионов металлов в организме человека
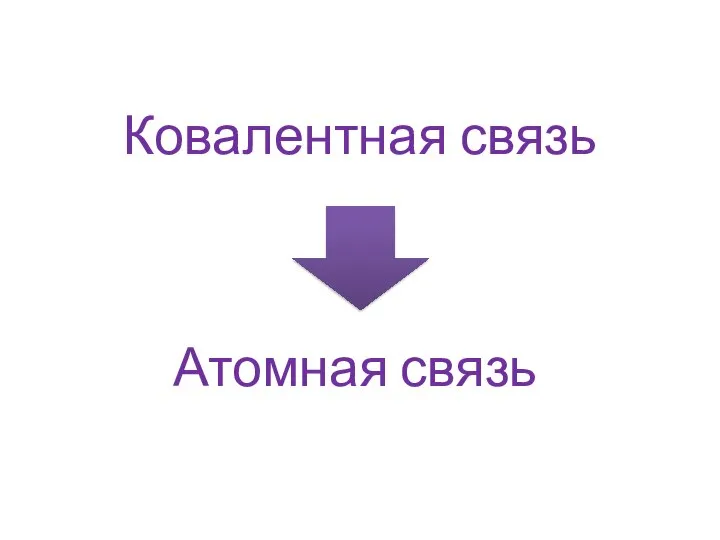
- 11. Ковалентная связь Связь, возникающая между атомами за счет образования общих электронных пар
- 12. Ковалентная связь Атомная связь
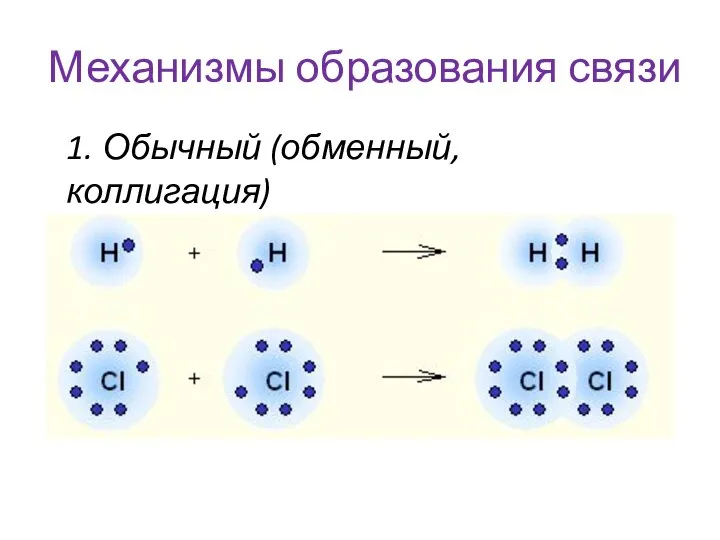
- 13. Механизмы образования связи 1. Обычный (обменный, коллигация)
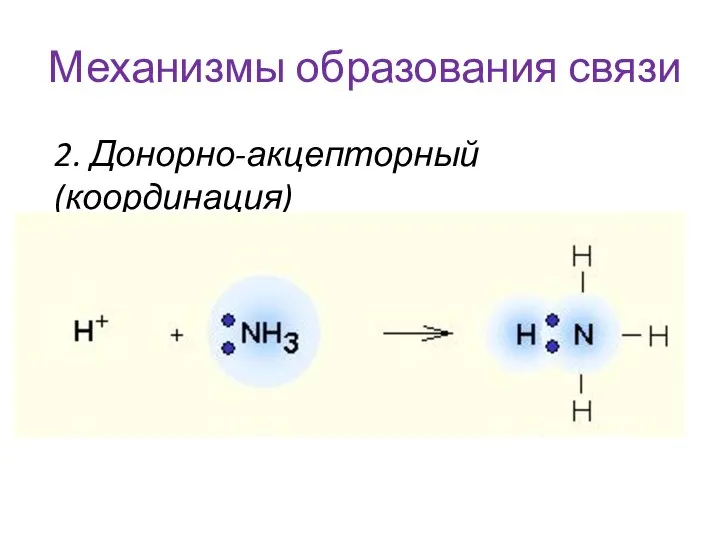
- 14. Механизмы образования связи 2. Донорно-акцепторный(координация)
- 15. Электроотрицательность Способность атомов химических элементов оттягивать к себе общие электронные пары
- 16. ЭО ЭО > 2 - неметалл В периоде ЭО возрастает В группе ЭО уменьшается Чем >
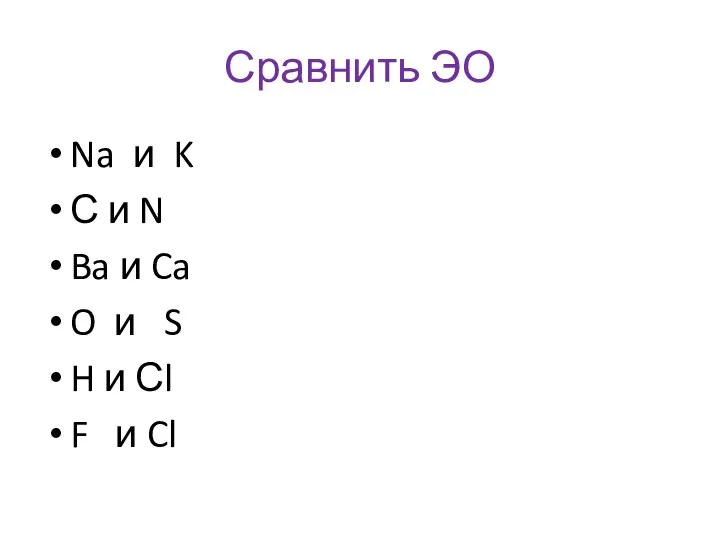
- 17. Сравнить ЭО Na и K С и N Ba и Ca O и S H и
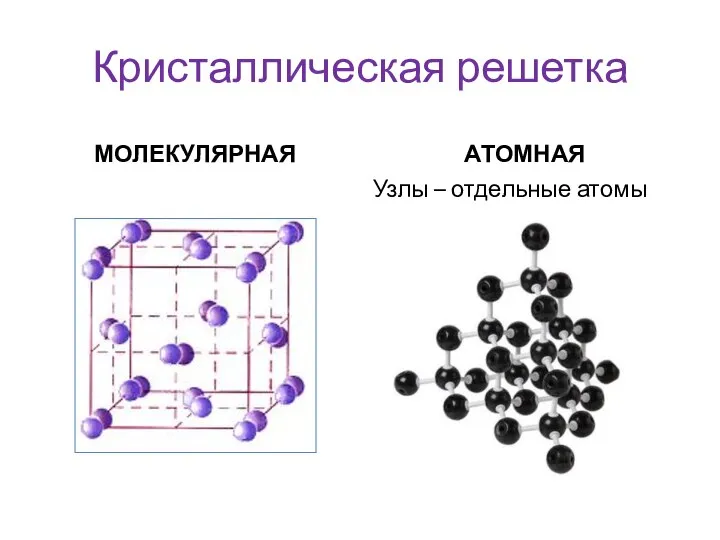
- 18. Кристаллическая решетка МОЛЕКУЛЯРНАЯ АТОМНАЯ Узлы – отдельные атомы
- 19. Аллотропия Существование одного и того же химического элемента в виде двух или нескольких простых веществ; Может
- 20. Металлическая связь Связь в металлах и сплавах между атом-ионами металлов, осуществляемая совокупностью валентных электронов
- 21. Me 0 - ne Men+ Механизм металлической связи
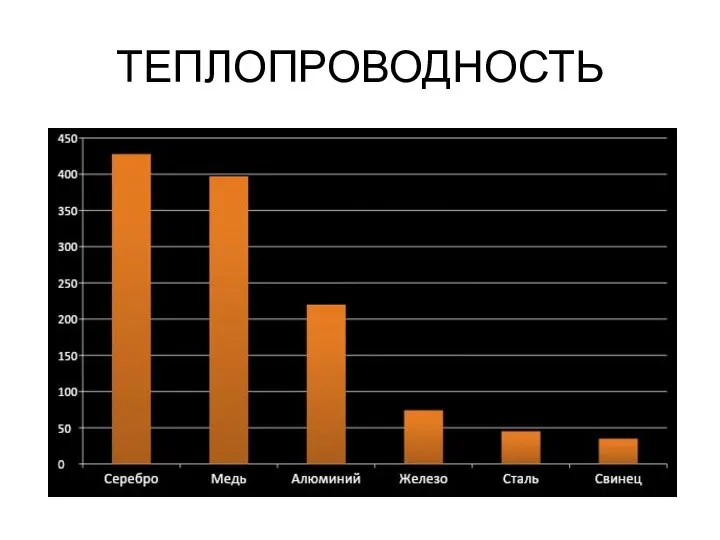
- 22. Свойства металлов Пластичность Электропроводность Теплопроводность Металлический блеск
- 23. ПЛАСТИЧНОСТЬ
- 24. ЭЛЕКТРОПРОВОДНОСТЬ
- 25. ТЕПЛОПРОВОДНОСТЬ
- 26. МЕТАЛЛИЧЕСКИЙ БЛЕСК
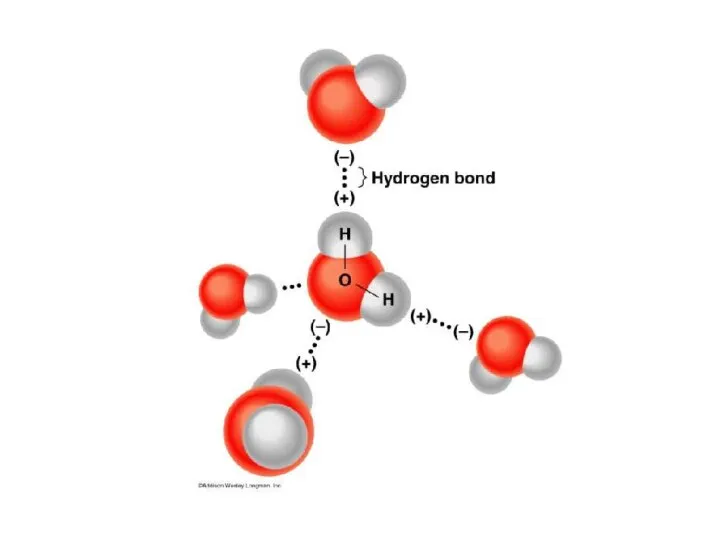
- 28. Водородная связь Связь между атомами водорода одной молекулы и атомами ЭО элементов (О; N ; Cl;
- 30. 1. внутримолекулярная 2. межмолекулярная
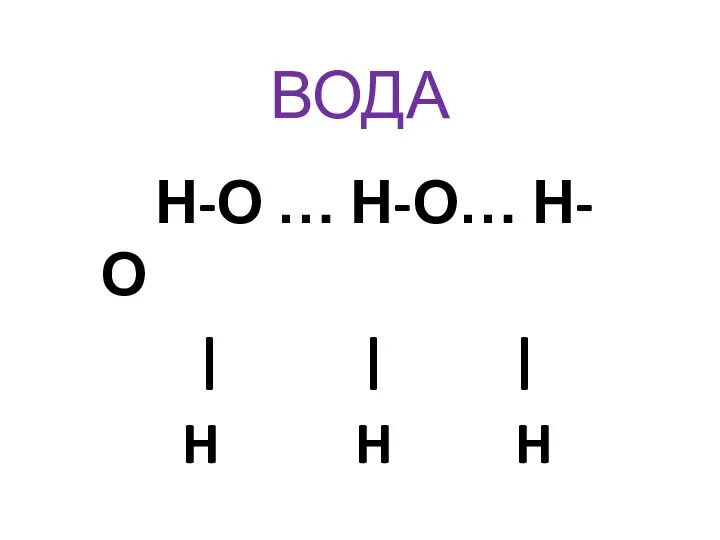
- 31. ВОДА Н-О … Н-О… Н-О | | | H H H
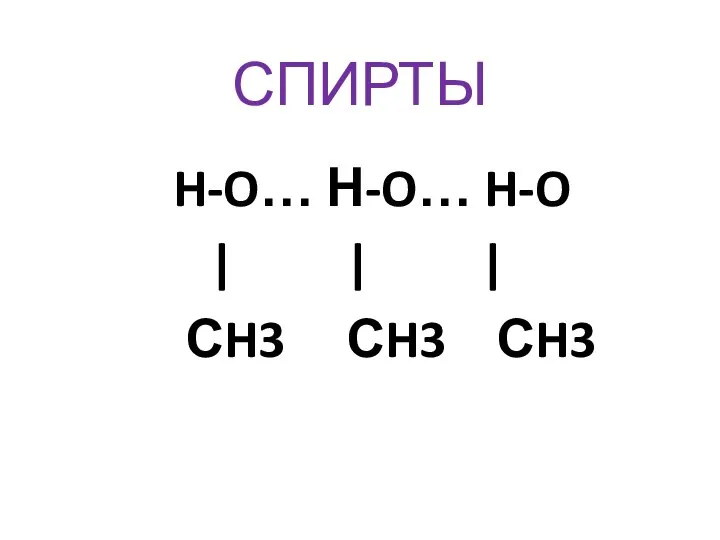
- 32. СПИРТЫ H-O… Н-O… H-O | | | СH3 СH3 СH3
- 34. Скачать презентацию









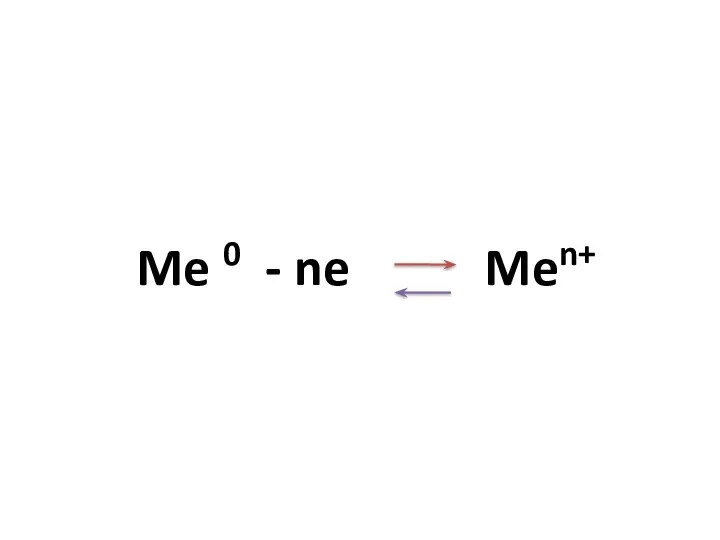







 Закономерности процессов нитрования НЦ
Закономерности процессов нитрования НЦ Урок повторения по химии за курс 8 класса
Урок повторения по химии за курс 8 класса “Су. Ерітінділер” тарауын қорытындылау
“Су. Ерітінділер” тарауын қорытындылау Презентація на тему: Корозія. Шляхи захисту від неї.
Презентація на тему: Корозія. Шляхи захисту від неї.  Научные фокусы. Лавовая лампа
Научные фокусы. Лавовая лампа МОУ СОШ №5 ст.Бриньковская УРОК ПО ТЕМЕ: «ЧИСТАЯ ВОДА» подготовила учитель химии Беба Е.А.
МОУ СОШ №5 ст.Бриньковская УРОК ПО ТЕМЕ: «ЧИСТАЯ ВОДА» подготовила учитель химии Беба Е.А.  Электрохимические методы анализа. (Лекция 7)
Электрохимические методы анализа. (Лекция 7) Земля дарує буйство кольорів, Нектару пахощами щедро поїть, Щоб кожен з нас, як свічечка, горів Перед іконою природи дорогої… Основа вічної краси – Молекули цих дивовижних речовин Лиш два складають елементи, І Оксиген один із них…
Земля дарує буйство кольорів, Нектару пахощами щедро поїть, Щоб кожен з нас, як свічечка, горів Перед іконою природи дорогої… Основа вічної краси – Молекули цих дивовижних речовин Лиш два складають елементи, І Оксиген один із них…  Классификация минералов
Классификация минералов Статья двумя способами. Приготовление катализатора
Статья двумя способами. Приготовление катализатора Алюминий и его соединения
Алюминий и его соединения Воздействие слюны на крахмал
Воздействие слюны на крахмал Взаимодействие кислоты с основанием (реакция нейтрализации)
Взаимодействие кислоты с основанием (реакция нейтрализации) Ароматические углеводороды (арены). Гомологи бензола
Ароматические углеводороды (арены). Гомологи бензола Микрофлора и биохимические реакции подземных вод
Микрофлора и биохимические реакции подземных вод Углеводы. Классификация углеводов
Углеводы. Классификация углеводов Электролиз
Электролиз  Простые вещества металлы 8 класс - Презентация по Химии_
Простые вещества металлы 8 класс - Презентация по Химии_ Коллоидная химия. Введение
Коллоидная химия. Введение Уральские горы. Самоцветы
Уральские горы. Самоцветы Литье под давлением термопластов
Литье под давлением термопластов Электролиз Работу выполнила учитель химии МОУ «Парбигская СОШ» Дьяченко
Электролиз Работу выполнила учитель химии МОУ «Парбигская СОШ» Дьяченко  Литье под давлением реактопластов
Литье под давлением реактопластов Презентация на тему Экологические проблемы Казахстана
Презентация на тему Экологические проблемы Казахстана  Химические свойства фурана, пиррола, тиофена. Биологически активные производные ряда фурана, пиррола, тиофена. (Лекция 3)
Химические свойства фурана, пиррола, тиофена. Биологически активные производные ряда фурана, пиррола, тиофена. (Лекция 3) Александр Михайлович Бутлеров
Александр Михайлович Бутлеров Жесткость воды Выполнил ученик 9 А класса Белов Андрей Руководитель учитель химии Залозных Ольга Владимировна
Жесткость воды Выполнил ученик 9 А класса Белов Андрей Руководитель учитель химии Залозных Ольга Владимировна Кислоты. Классификация. Свойства
Кислоты. Классификация. Свойства