Содержание
- 3. Металлический блеск
- 4. Высокие теплопроводность и электропроводность
- 5. Плотность и ковкость
- 6. Температура плавления Ртуть (Hg) Wilco Oelen
- 7. Температура плавления Цезий (Cs) Галлий (Ga) 29°C 29,8°C Aiyizo Dnn87
- 8. Температура плавления Вольфрам (W)
- 9. Твёрдость Alchemist-hp Хром (Cr)
- 10. Твёрдость Калий (K) Рубидий (Rb) Цезий (Cs) Dnn87 Dnn87 Dnn87
- 11. Физические свойства металлов заключаются в том, что они ковкие, пластичные, тягучие вещества, которые способны проводить тепло
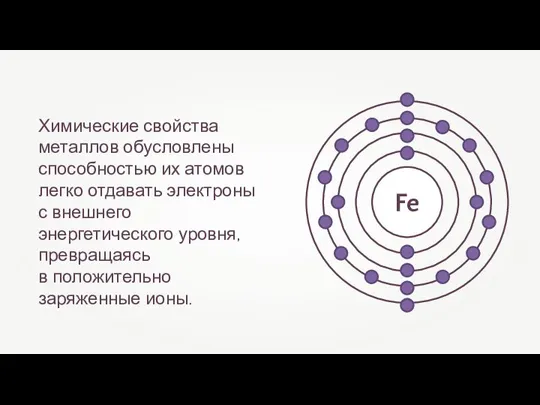
- 12. Химические свойства металлов обусловлены способностью их атомов легко отдавать электроны с внешнего энергетического уровня, превращаясь в
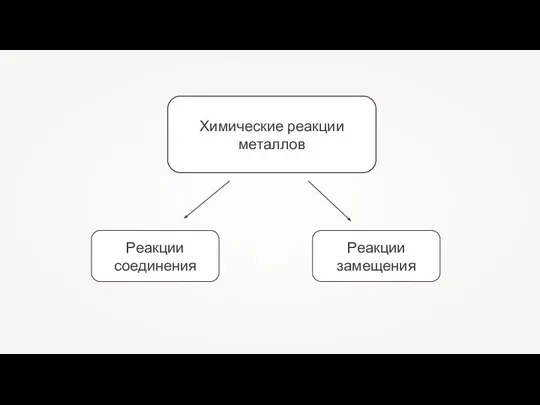
- 13. Химические реакции металлов
- 14. Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы одного из
- 15. Реакции соединения — это такие реакции, в результате которых из одного или нескольких веществ образуется одно
- 16. Me - ne → Me В химических реакциях металлы способны отдавать электроны, т.е. быть восстановителями, проявлять
- 17. Взаимодействие металлов с неметаллами 2Mg + О2 = 2MgО t 0 0 +2 -2
- 20. Взаимодействие металлов с неметаллами с образованием солей 2Al + 3Br2 = 2AlBr3 0 0 +3 -1
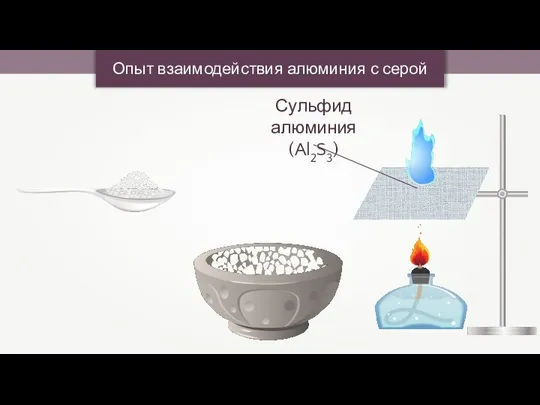
- 21. Опыт взаимодействия алюминия с серой
- 22. Опыт взаимодействия алюминия с серой
- 23. Взаимодействие алюминия с серой 2Al + 3S = Al2S3 0 0 +3 -2 Окислитель
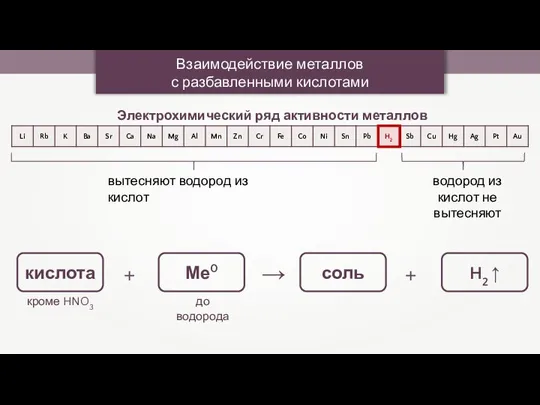
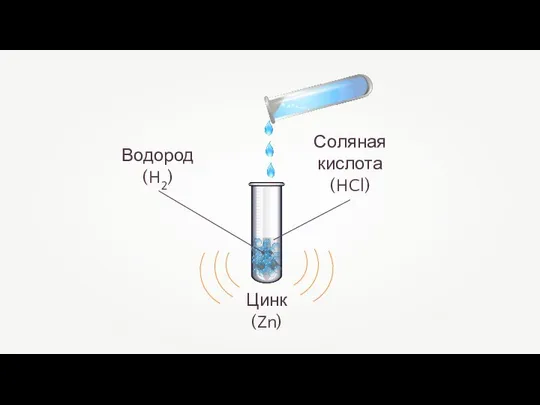
- 24. Взаимодействие металлов с разбавленными кислотами Электрохимический ряд активности металлов вытесняют водород из кислот водород из кислот
- 25. Взаимодействие цинка с соляной кислотой Zn + 2HCl = ZnCl2 + H2↑ +1 0 +2 0
- 26. Цинк (Zn)
- 27. Взаимодействие металлов с кислотами Электрохимический ряд активности металлов взаимодействуют с разбавленными кислотами реагируют с концентрированными кислотами
- 28. Взаимодействие металла с водой Электрохимический ряд активности металлов активные металлы 2Na + 2H2O → 2NaOH +
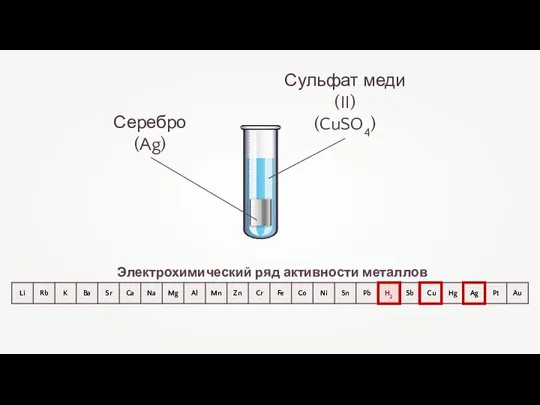
- 29. Взаимодействие металлов с растворами солей Электрохимический ряд активности металлов взаимодействуют с растворами солей Cu + 2AgNO3
- 30. Медь (Cu) Взаимодействие меди с нитратом серебра
- 31. Взаимодействие меди с нитратом серебра Cu + 2AgNO3 = Cu(NO3)2 + 2Ag Окислитель Восстановитель
- 32. Электрохимический ряд активности металлов
- 34. Скачать презентацию

























 Свойства простых веществ 8 класс
Свойства простых веществ 8 класс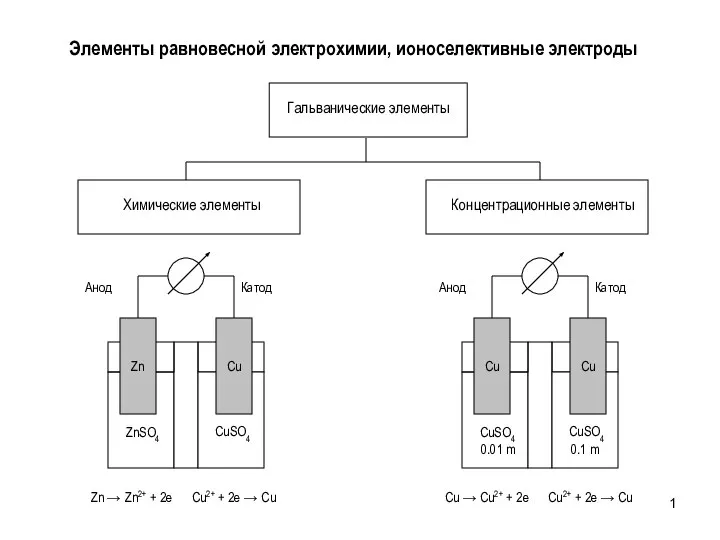 Элементы равновесной электрохимии, ионоселективные электроды
Элементы равновесной электрохимии, ионоселективные электроды Соединения алюминия
Соединения алюминия Алканы. Физические и химические свойства
Алканы. Физические и химические свойства Физическая технология топлива. Направления переработки нефти. Классификация нефтепродуктов
Физическая технология топлива. Направления переработки нефти. Классификация нефтепродуктов Презентация по химии Амины
Презентация по химии Амины Презентация по Химии "Самодельная грелка" - скачать смотреть
Презентация по Химии "Самодельная грелка" - скачать смотреть  Общие представления об электрохимических технологиях
Общие представления об электрохимических технологиях Смазочные материалы. Моторные масла
Смазочные материалы. Моторные масла ИЗОМЕРИЯ И СТРОЕНИЕ КС. СПОСОБНОСТЬ АТОМОВ РАЗЛИЧНЫХ ЭЛЕМЕНТОВ К КОМПЛЕКСООБРАЗОВАНИЮ. УСТОЙЧИВОСТЬ КС Лектор: канд. хим. н
ИЗОМЕРИЯ И СТРОЕНИЕ КС. СПОСОБНОСТЬ АТОМОВ РАЗЛИЧНЫХ ЭЛЕМЕНТОВ К КОМПЛЕКСООБРАЗОВАНИЮ. УСТОЙЧИВОСТЬ КС Лектор: канд. хим. н Изучение слёзного аппарата человека, функций плача и состав слёз
Изучение слёзного аппарата человека, функций плача и состав слёз Физические свойства полимеров
Физические свойства полимеров Общая характеристика элементов VIA-группы (халькогены). Сера. Кислород
Общая характеристика элементов VIA-группы (халькогены). Сера. Кислород Анализ пищевых добавок (маркировка Е) используемых в продуктовой линейке Витамакс
Анализ пищевых добавок (маркировка Е) используемых в продуктовой линейке Витамакс Определение предмета биофизики
Определение предмета биофизики Органічна хімія
Органічна хімія Гелий. Физико-химические свойства
Гелий. Физико-химические свойства Алканы. Алканы.
Алканы. Алканы. Заттардың агрегаттық күйлері
Заттардың агрегаттық күйлері Скорость химических реакций. Факторы, влияющие на скорость химических реакций
Скорость химических реакций. Факторы, влияющие на скорость химических реакций Хлороводород..Соляная кислота
Хлороводород..Соляная кислота Применение дидактических игр на уроках химии
Применение дидактических игр на уроках химии Определение исходного металла. Решение задачи алгебраическим методом. Исайкин Александр Михайлович учитель химии МОУ «СОШ
Определение исходного металла. Решение задачи алгебраическим методом. Исайкин Александр Михайлович учитель химии МОУ «СОШ  Нуклеофильное замещение галогена и других функциональных групп
Нуклеофильное замещение галогена и других функциональных групп 140 лет дому, который построил Д.И. Менделеев
140 лет дому, который построил Д.И. Менделеев Сера
Сера Растворы. Способы выражения концентрации растворенного вещества
Растворы. Способы выражения концентрации растворенного вещества Презентация Элементы таблицы Менделеева
Презентация Элементы таблицы Менделеева