Содержание
- 2. Данный урок служит для формирования предметных и метапредметных знаний, умений и навыков у учащихся 9 класса
- 3. Результат урока: сформировать у учащихся знания по теме «Соединения углерода» через активное изучение материала (в форме
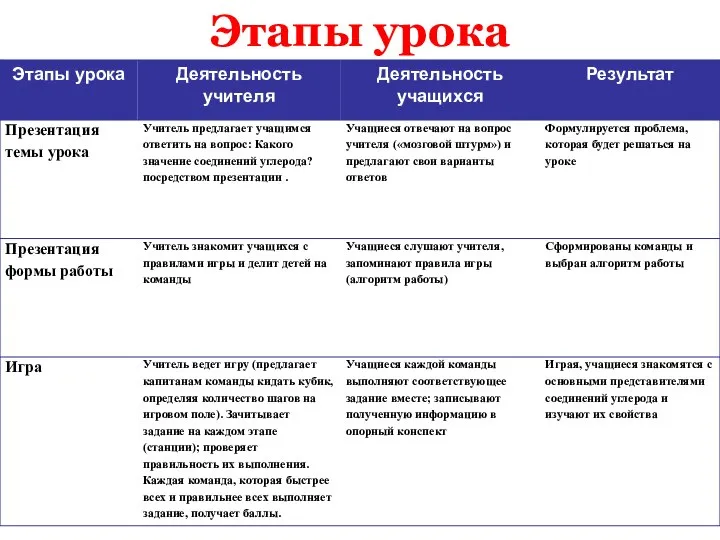
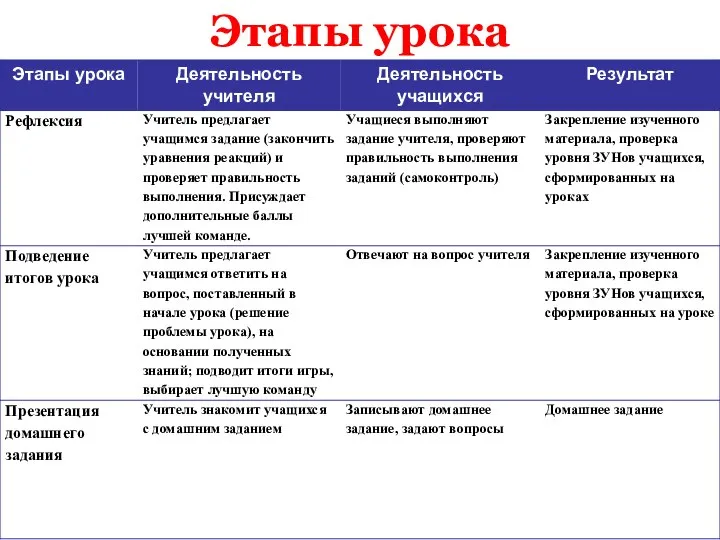
- 4. Этапы урока
- 5. Этапы урока
- 6. СОЕДИНЕНИЯ УГЛЕРОДА: ДРУЗЬЯ или ВРАГИ? учитель химии КНЯЗЕВА Екатерина Александровна школа № 507 Санкт-Петербург
- 7. Na2CO3 техническая сода
- 8. CaCO3 известняк
- 9. CaCO3 мрамор
- 10. (Cu(OH)2)CO3 малахит
- 11. каменный уголь
- 12. нефть
- 13. природный газ
- 20. СОЕДИНЕНИЯ УГЛЕРОДА: ДРУЗЬЯ или ВРАГИ?
- 21. Известно, что оксид серы (IV) при растворении в воде образует неустойчивую сернистую кислоту и как типичный
- 22. SO2 +H2O H2SO3 SO2 +Ca(OH)2 Ca SO3+2H2O CO2 +H2O CO2 +Ca(OH)2
- 23. CO2 +H2O H2CO3 CO2 +Ca(OH)2 CaCO3 + 2H2O CO2 CaCO3
- 24. CO2 CaCO3
- 25. Что произойдет, если пропустить углекислый газ через раствор гидроксида кальция? Составьте соответствующие уравнения реакций.
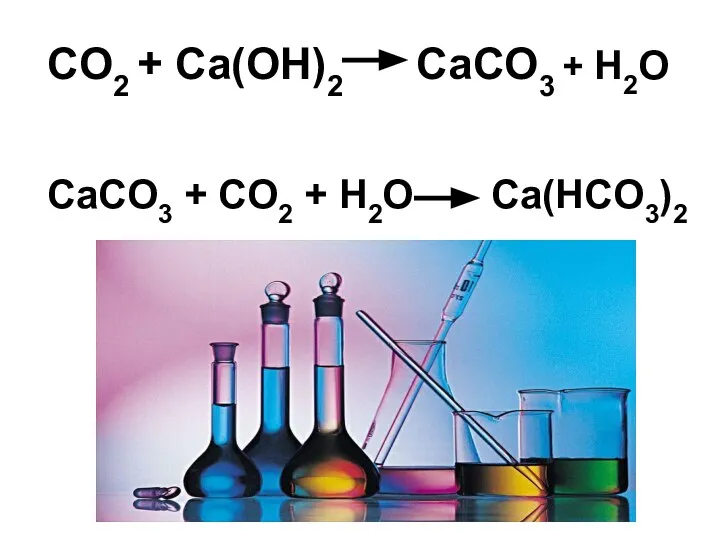
- 26. CO2 + Ca(OH)2 CaCO3 + H2O CaCO3 + CO2 + H2O Ca(НCO3)2 +
- 27. Соли угольной кислоты Карбонаты CaCO3 мрамор ГидрокарбонатыNaHCO3 питьевая сода
- 28. Страшная тайна
- 29. Соли угольной кислоты, как и все прочие обладают рядом особых свойств. Одно из них сокрыто в
- 30. Все нерастворимые карбонаты, а также гидрокарбонаты разлагаются при нагревании с образованием углекислого газа: CaCO3 t CO2+
- 31. (NH4)2CO3 CO2 +2NH3+H2O t
- 32. Ca(HCO3)2 t CO2+ CaCO3+ H2O t
- 33. В лаборатории произошло ЧП: от нескольких склянок с реактивами оторвались этикетки. Известно, что в нескольких из
- 34. Карбонаты взаимодействуют с кислотами (качественная реакция на карбонат-ион): СaCO3 +2HCl CaCl2 + H2O+CO2
- 35. NaHCO3 +CH3COOH CH3COONa+CO2+H2O
- 36. СaCO3 +2HCl CaCl2 + H2O+CO2
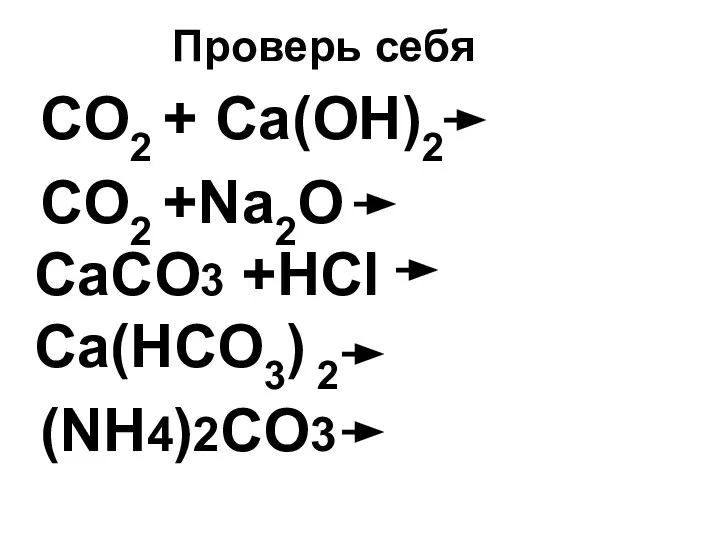
- 37. Проверь себя CO2 + Ca(OH)2 CO2 +Na2O СaCO3 +HCl Ca(HCO3) 2 (NH4)2CO3
- 38. CO2 + Ca(OH)2 СaCO3 + H2O CO2 +Na2O Na2CO3 СaCO3 +2HCL CaCl2+H2O+CO2 Ca(HCO3)2 t CO2+ CaCO3
- 40. Скачать презентацию

















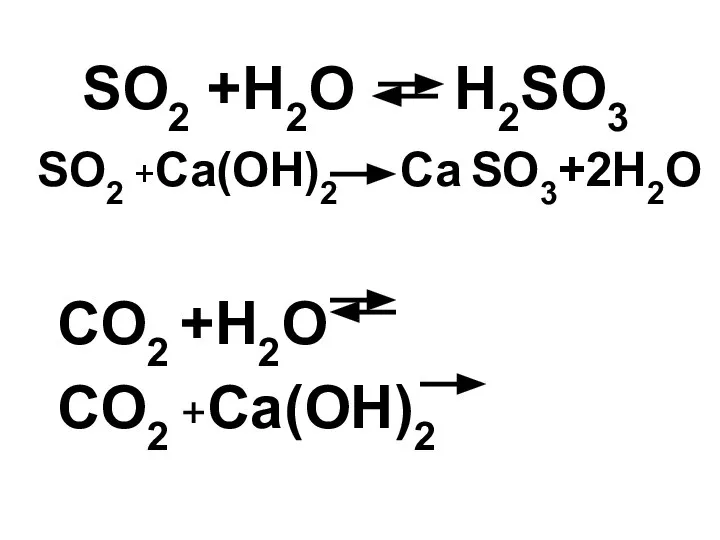
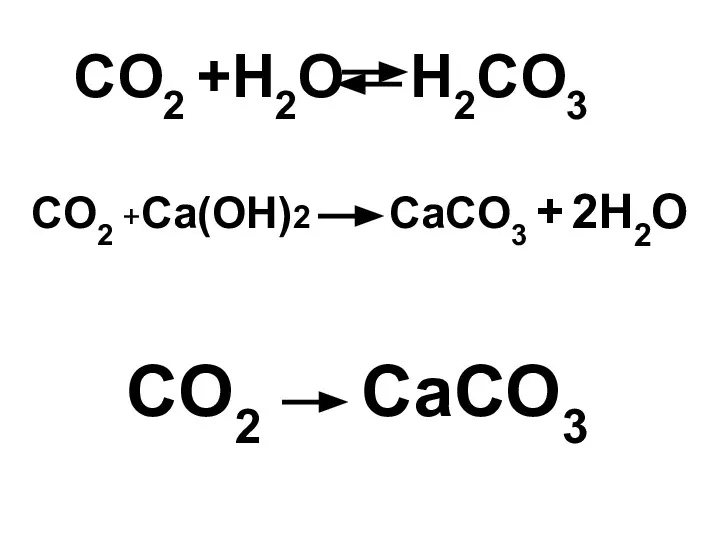







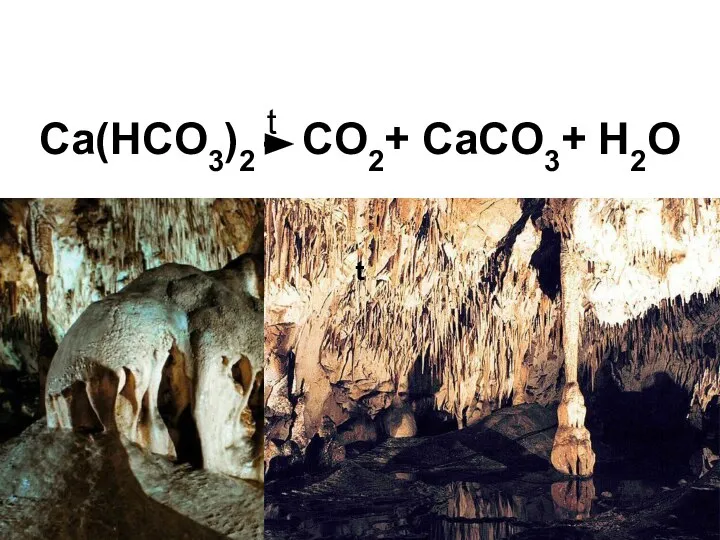




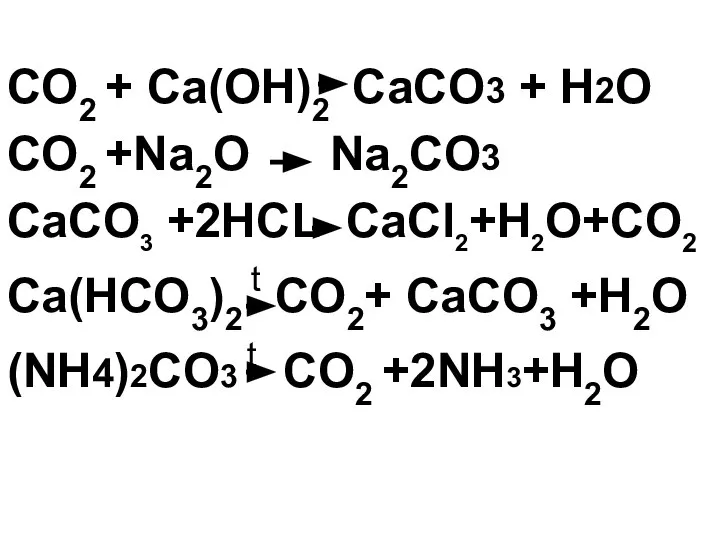
 Харчові добавки. e-числа Підготувала учениця 7(11)-Б класу Луцької гімназії №4 Імені Модеста Левицького Цибульська Вікторія
Харчові добавки. e-числа Підготувала учениця 7(11)-Б класу Луцької гімназії №4 Імені Модеста Левицького Цибульська Вікторія  Презентация к уроку «Вода – важнейшее бинарное соединение»
Презентация к уроку «Вода – важнейшее бинарное соединение»  Хлороводород. Соляная кислота.
Хлороводород. Соляная кислота.  Қышқылдар мен сілтілер тепе-теңдігі
Қышқылдар мен сілтілер тепе-теңдігі Классификация химических элементов
Классификация химических элементов Липидтер
Липидтер Наукові напрямки практичної реалізації принципів «Зеленої» хімії
Наукові напрямки практичної реалізації принципів «Зеленої» хімії Свойства радиоактивных элементов
Свойства радиоактивных элементов Углеводы. 10 класс
Углеводы. 10 класс Полимер и пластмасса
Полимер и пластмасса Элементы нелинейного функционального анализа
Элементы нелинейного функционального анализа Стереоизомерия. Энантиомерия. Энантиомеры. Хиральность. Условия хиральности
Стереоизомерия. Энантиомерия. Энантиомеры. Хиральность. Условия хиральности Тест 1.Тип кристаллической решетки у белого фосфора…. а) молекулярный б) атомный в) ионный а) молекулярный Р4 2. У фосфора…..
Тест 1.Тип кристаллической решетки у белого фосфора…. а) молекулярный б) атомный в) ионный а) молекулярный Р4 2. У фосфора…..  Аттестационная работа. Программа элективного курса химия и военное дело. (8-9 класс)
Аттестационная работа. Программа элективного курса химия и военное дело. (8-9 класс) Алюминий и элементы подгруппы галлия (Ga, In, Tl)
Алюминий и элементы подгруппы галлия (Ga, In, Tl) Углеводы, монозы, биозы. Лекция 15
Углеводы, монозы, биозы. Лекция 15 VI группа периодической системы. VIA-группа
VI группа периодической системы. VIA-группа Побочная подгруппа VIII группы периодической системы
Побочная подгруппа VIII группы периодической системы Исследование химического состава шоколада и способов его приготовления
Исследование химического состава шоколада и способов его приготовления Диктант: название алканов
Диктант: название алканов Химия элементов - неметаллов Сера Автор: Цуркан Лилия Фёдоровна учитель химии МОУ « ТСШ № 17» г. Тирасполь
Химия элементов - неметаллов Сера Автор: Цуркан Лилия Фёдоровна учитель химии МОУ « ТСШ № 17» г. Тирасполь Основы органической химии
Основы органической химии Презентация по Химии "Хімія і екологія" - скачать смотреть бесплатно
Презентация по Химии "Хімія і екологія" - скачать смотреть бесплатно Электролитическая диссоциация Выполнила учитель химии и экологии МОУ «СОШ с.Усть-Курдюм» Филимонова Ирина Вячеславовна
Электролитическая диссоциация Выполнила учитель химии и экологии МОУ «СОШ с.Усть-Курдюм» Филимонова Ирина Вячеславовна Обобщение и систематизация знаний по теме «Спирты и фенолы»
Обобщение и систематизация знаний по теме «Спирты и фенолы» Презентация по химии Фотометрический анализ
Презентация по химии Фотометрический анализ Презентация по химии Ферменты
Презентация по химии Ферменты  Общая характеристика элементов IБгруппы. Медь. Серебро. Золото
Общая характеристика элементов IБгруппы. Медь. Серебро. Золото