Содержание
- 2. Задачи урока: Воспитательные: создать условия для воспитания самостоятельности при выполнении химического эксперимента, воспитание норм морали: взаимопомощи,
- 3. Эпиграф. Источник всякой науки есть опыт. Ю. Либих Источник всякой науки есть опыт. Ю. Либих Источник
- 4. Тема исследования. Скорость химических реакций. Факторы, влияющие на скорость химических реакций. Цель исследования. Определить что такое
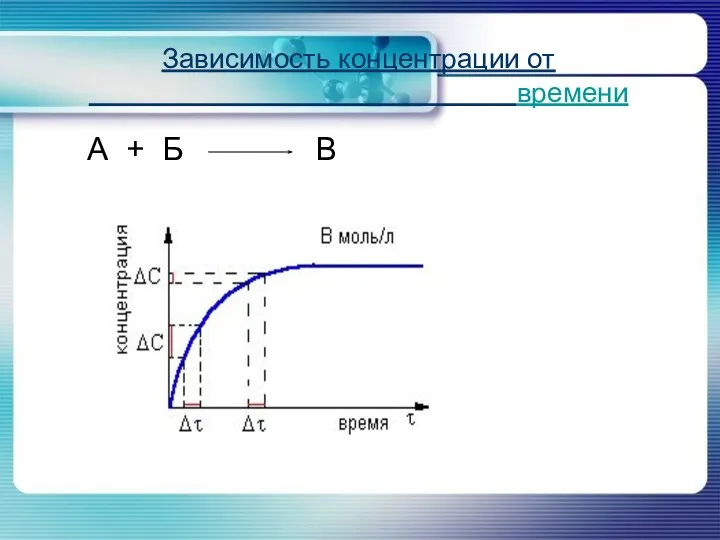
- 5. Зависимость концентрации от времени А + Б В
- 6. Скорость реакции определяется изменением количества вещества в единицу времени
- 7. Итак, на основании выдвинутых гипотез скорость химических реакций зависит от: Природы реагирующих веществ Концентрации Температуры Площади
- 8. Опыт 1. Природа реагирующих веществ. В один сосуд Ландольта помещают цинк, в другой медь. В оба
- 9. Опыт 2. Концентрация реагирующих веществ. В две пробирки поместите по кусочку цинка. В одну прилейте разбавленный
- 10. Кинетические уравнения 1867 год- К.Гульдберг, П.Вааге; 1865 год- Н.И. Бекетов. «Скорость химической реакции пропорциональна произведению концентраций
- 11. Опыт 3. Температура. В пробирку с алюминием прилить кислоту. Понаблюдать. А затем осторожно нагреть. Что происходит
- 12. Уравнение Вант -Гоффа Повышение температуры на каждые 10 ∙С приводит к увеличению скорости реакции в 2-4
- 13. Опыт 4. Площадь соприкосновения Вывод: Чем больше площадь соприкосновения, тем выше скорость реакции.
- 14. Опыт 5. Присутствие катализатора. В пробирку прилить небольшое количество раствора перекиси водорода. Добавить немного MnO2. Поднести
- 15. Тестовое задание 1. При комнатной температуре с наибольшей скоростью протекает реакция между 1) Zn и HCl
- 16. Тестовое задание 3. С наибольшей скоростью при обычных условиях взаимодействуют 1) цинк и соляная кислота 2)
- 17. Подумай! Почему продукты питания необходимо хранить в холодильнике? Объясни с точки зрения кинетики химических реакций.
- 19. Скачать презентацию















 Энергетика химических реакций
Энергетика химических реакций Ингибиторы
Ингибиторы Оксид углерода-С
Оксид углерода-С Кислоты 9-10 класс - Презентация_
Кислоты 9-10 класс - Презентация_ Презентация по Химии "Электролиз расплавов и растворов" - скачать смотреть
Презентация по Химии "Электролиз расплавов и растворов" - скачать смотреть  Презентация Углекислый газ 9 класс
Презентация Углекислый газ 9 класс Минералы. Принципы классификации минералов
Минералы. Принципы классификации минералов 1oe_zanyatie (1)
1oe_zanyatie (1) Химия в строительстве
Химия в строительстве Содержание ионов в растворе
Содержание ионов в растворе Липиды. Содержание липидов в клетках
Липиды. Содержание липидов в клетках Коллоидное состояние вещества
Коллоидное состояние вещества Обмен белков - 1
Обмен белков - 1 Тест с подсказками для закрепления знаний по теме Кислоты (8 класс)
Тест с подсказками для закрепления знаний по теме Кислоты (8 класс) What is enthalpy?
What is enthalpy? ПРЕЗЕНТАЦИЯ НА ТЕМУ : Бензол и его свойства. Выполнила: ученица 11-Б класса
ПРЕЗЕНТАЦИЯ НА ТЕМУ : Бензол и его свойства. Выполнила: ученица 11-Б класса  Учитель химии МБОУ СОШ №79 г. о. Самара Язрикова Любовь Михайловна
Учитель химии МБОУ СОШ №79 г. о. Самара Язрикова Любовь Михайловна Липиды. Переваривание, всасывание, транспорт. (Лекция 8)
Липиды. Переваривание, всасывание, транспорт. (Лекция 8) Тайна воды которую мы пьём
Тайна воды которую мы пьём Конструкционные и функциональные волокнистые композиты. Органические волокна
Конструкционные и функциональные волокнистые композиты. Органические волокна Циклоалканы (полиметиленовые, циклопарафины, ациклические)
Циклоалканы (полиметиленовые, циклопарафины, ациклические) Омега 3
Омега 3  Кеvектілік, Қанықтылық
Кеvектілік, Қанықтылық Вспомогательные вещества. Флюсы и их применение. Кислоты, соли, щёлочи применяемые в ювелирном деле. (Лекция 3)
Вспомогательные вещества. Флюсы и их применение. Кислоты, соли, щёлочи применяемые в ювелирном деле. (Лекция 3) Современные методы поиска химической информации
Современные методы поиска химической информации Химический элемент селен
Химический элемент селен Химический состав клетки. Вода и ее роль в жизнедеятельности клетки. Минеральные вещества
Химический состав клетки. Вода и ее роль в жизнедеятельности клетки. Минеральные вещества Общая и медицинская химия
Общая и медицинская химия