Содержание
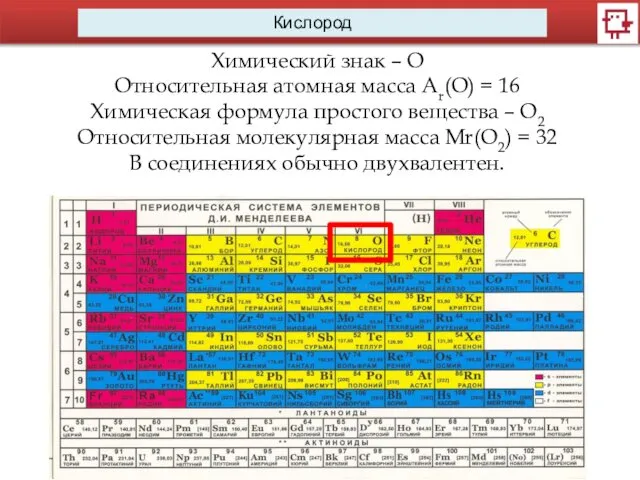
- 2. Кислород Химический знак – О Относительная атомная масса Ar(O) = 16 Химическая формула простого вещества –
- 3. Кислород Свойства Физические Химические
- 4. Кислород Физические свойства кислорода Бесцветный газ, без вкуса и запаха. Плохо растворим в воде (на 100
- 5. Кислород Химические свойства. При нагревании кислород энергично реагирует со многими веществами. При таких реакциях выделяется энергия
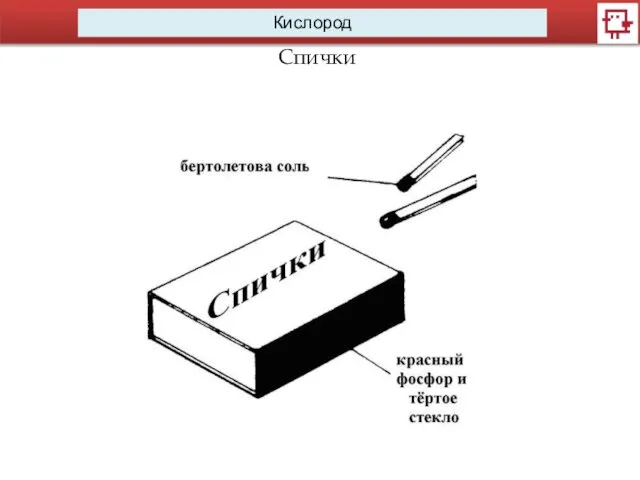
- 6. Кислород Спички
- 7. Кислород Спички Хенниг Бранд Первые фосфорные спички – Шарль Сория, 1831 г. Они были с Р4
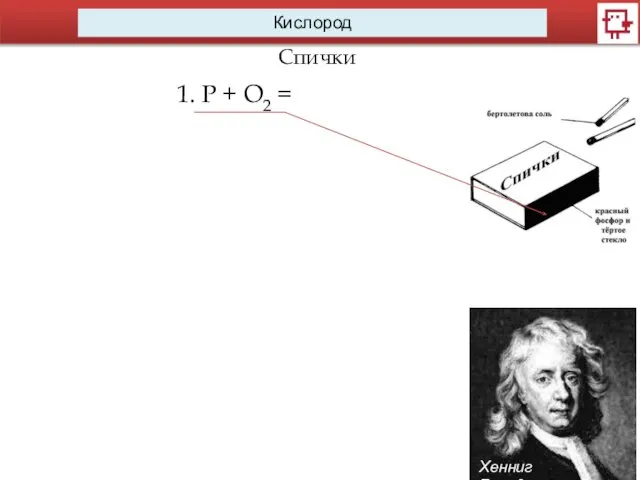
- 8. Кислород Спички Хенниг Бранд 1. P + O2 =
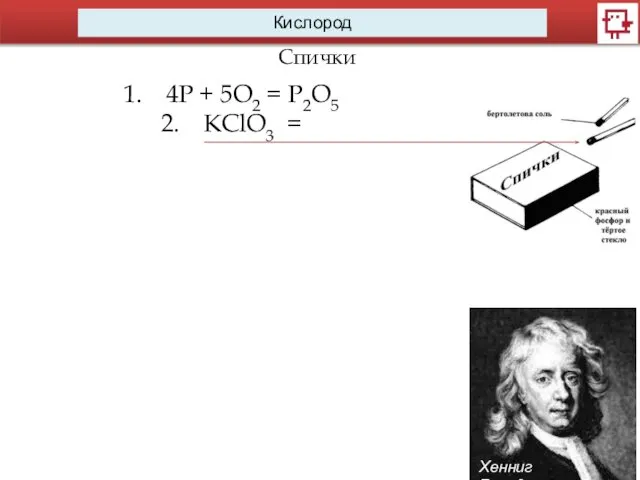
- 9. Кислород Спички Хенниг Бранд 4P + 5O2 = P2O5 KClO3 =
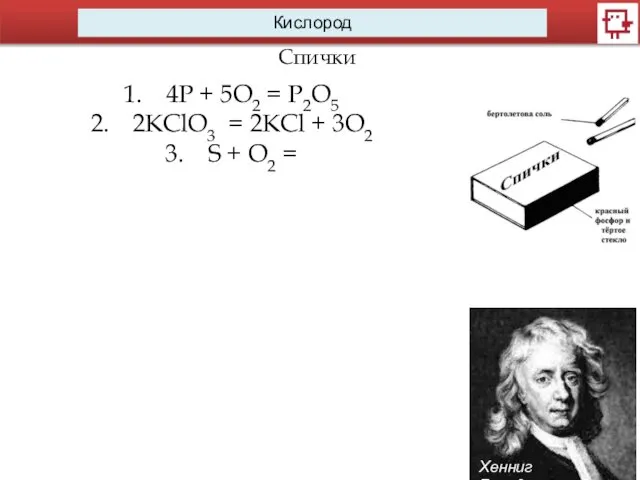
- 10. Кислород Спички Хенниг Бранд 4P + 5O2 = P2O5 2KClO3 = 2KCl + 3O2 S +
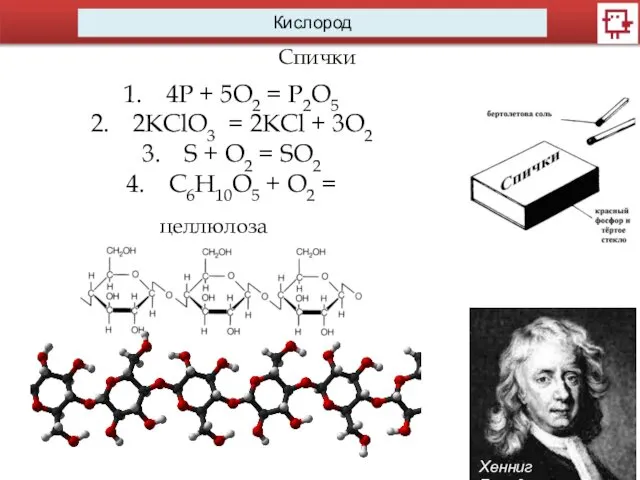
- 11. Кислород Спички Хенниг Бранд 4P + 5O2 = P2O5 2KClO3 = 2KCl + 3O2 S +
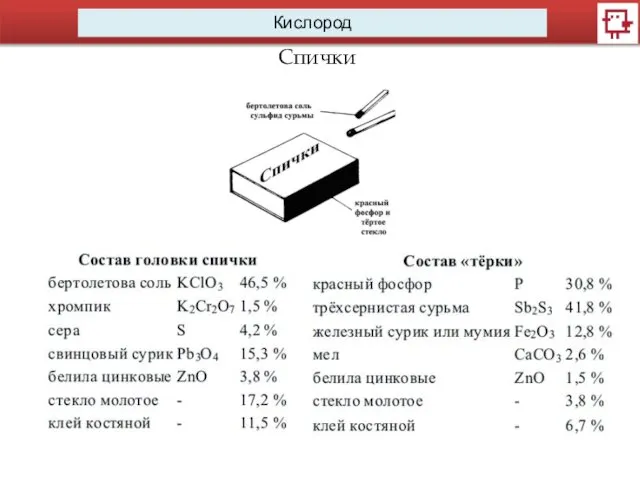
- 12. Кислород Спички
- 13. Кислород Можно ли поджечь железо?
- 14. Кислород Fe + O2 = Fe2O3 или Fe3O4
- 15. Кислород Fe + O2 = Fe2O3 или Fe3O4 Когда реагирует простое вещество и кислород, как правило,
- 17. Скачать презентацию






 Кристалл. Основные законы кристаллографии
Кристалл. Основные законы кристаллографии Амины, анилин
Амины, анилин Коррозия металлов
Коррозия металлов Additives for Polymeric Materials
Additives for Polymeric Materials Правила безпечного використання засобів побутової хімії Підготував ліцеїст групи Е-2 Ліщук Назарій
Правила безпечного використання засобів побутової хімії Підготував ліцеїст групи Е-2 Ліщук Назарій  ЗАСТОСУВАННЯ РІДКИХ КРИСТАЛІВ Виконала учениця 10 класу Гаєвська Зоряна
ЗАСТОСУВАННЯ РІДКИХ КРИСТАЛІВ Виконала учениця 10 класу Гаєвська Зоряна  Получение ЛС неорганической природы
Получение ЛС неорганической природы d-Элементы I Б группы
d-Элементы I Б группы 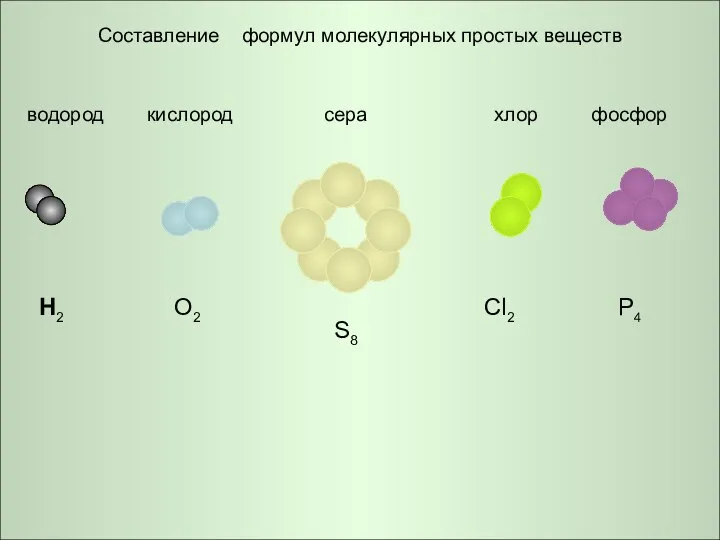 Составление формул молекулярных простых веществ
Составление формул молекулярных простых веществ Формирование и развитие системы знаний о химической реакции
Формирование и развитие системы знаний о химической реакции Промежуточный обмен
Промежуточный обмен Жидкостная хроматография
Жидкостная хроматография Синтез непредельных производных и сополимеров хитозана для разработки фоточувствительных композиций на основе биополимеров
Синтез непредельных производных и сополимеров хитозана для разработки фоточувствительных композиций на основе биополимеров Granite
Granite Количество вещества
Количество вещества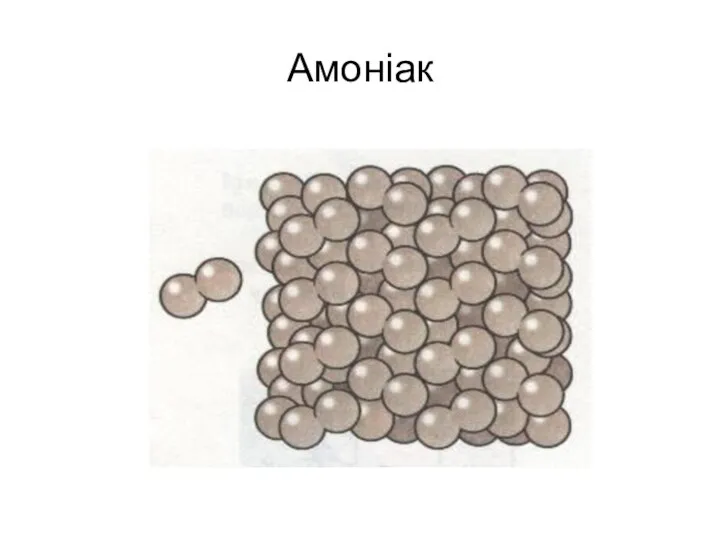 Амоніак
Амоніак  Ферменти мікробіологічного синтезу
Ферменти мікробіологічного синтезу Окисно-відновні реакції у природі і промисловості
Окисно-відновні реакції у природі і промисловості Эндогенная серия. Магматическая группа
Эндогенная серия. Магматическая группа Идеальный газ в молекулярно-кинетической теории. Среднее значение квадрата скорости молекул
Идеальный газ в молекулярно-кинетической теории. Среднее значение квадрата скорости молекул Органика вокруг нас
Органика вокруг нас Кислородные соединения азота
Кислородные соединения азота Повторительное обобщение по неорганической химии, подготовка к ГИА
Повторительное обобщение по неорганической химии, подготовка к ГИА Производства на основе нефтяного и газового сырья
Производства на основе нефтяного и газового сырья Определение содержания иона цинка в фармацевтическом препарате гравиметрическим методом
Определение содержания иона цинка в фармацевтическом препарате гравиметрическим методом Презентация по Химии "Значение химии" - скачать смотреть бесплатно
Презентация по Химии "Значение химии" - скачать смотреть бесплатно Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Презентация по химии Руды металлов
Презентация по химии Руды металлов