Содержание
- 2. Общая характеристика группы. 28Cu − 1s22s22p63s23p63d104s1; [Ar] 3d104s1 47Ag − 1s22s22p63s23p63d104s24p64d105s1; [Kr] 4d105s1 79Au − 1s22s22p63s23p63d104s24p64d104f145s25p65d106s1;
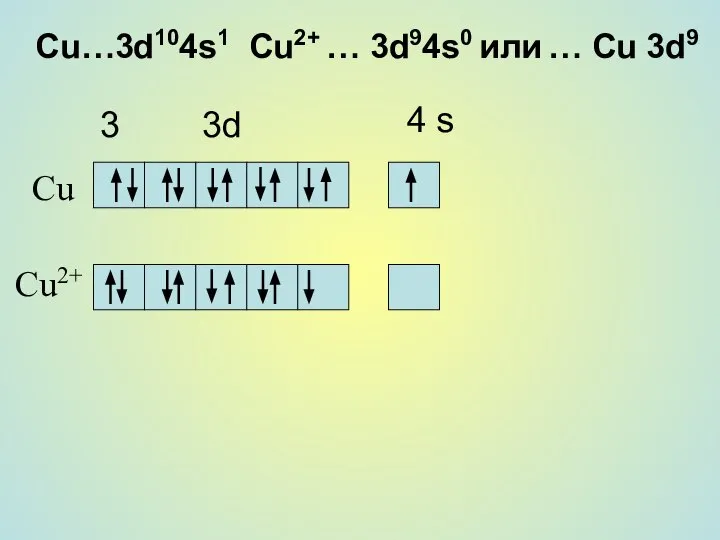
- 3. Cu…3d104s1 Cu2+ … 3d94s0 или … Cu 3d9 3 3d 4 s Cu Cu2+
- 4. Стандартные электродные потенциалы d-элементов 1Б группы .. H2 … Cu … Ag… Au …
- 5. Для меди наиболее характерна степень окисления +2, для серебра +1, для золота +3. Особая устойчивость степени
- 6. Радиусы атомов элементов побочной подгруппы I группы гораздо меньше, чем у металлов главной подгруппы, поэтому медь,
- 7. При переходе от меди к серебру радиус атомов увеличивается, а у золота не изменяется, т. к.
- 8. Нахождение в природе. В природе встречается в виде различных соединений, Cu2S - медный блеск, CuFeS2 -
- 9. Медь Сu довольно мягкий металл красного цвета, Tпл = 1083°С, обладает высокой электро- и теплопроводностью, образует
- 10. Способы получения. Продувание О2 через расплав сульфида меди (I): 2Cu2S + 3О2 = 2Cu2O + 2SO2;
- 11. Химические свойства
- 12. 2Сu + О2 = 2СuО (800°С); Сu + S = CuS (350°C); Сu + Сl2 =СuСl2;
- 13. Сu + 4НNО3(конц) = 2NO2 + Cu(NO3)2 + 2Н2О; 3Сu + 8НNО3(разб) = 2NO + 3Cu(NO3)2
- 14. Оксид меди (I) Сu2О - твердое вещество темно-красного цвета, обладает основными свойствами. Часть солей меди (I)
- 15. Сu2О + 2НСl(разб) = 2CuCl? + H2O; Сu2О + 4НСl(изб.) = 2H[CuCl2] + H2O; 2Сu2О +
- 16. Оксид меди (II) СuО - твердое вещество красно-коричневого цвета, проявляет основные свойства. 4CuO = 2Cu2O+ O2;
- 17. СuО + СО = Сu + СО2; 3СuО + 2NH3(г) = N2 + 3Сu + 3H2О;
- 18. Гидроксид меди (II) Сu(ОН)2 - соединение голубого цвета, не растворим в воде, термически неустойчив, преобладают основные
- 19. 2Cu(OH)2 + CO2 = Cu2 ( ОН)2 СО3?- + H2O; Cu(OH)2 = CuO + 2H2O; Cu(OH)2
- 20. Соединения меди (II) – окислители: CuSO4+ M = Cu↓ + MSO4 (М = Fе, Zn) 2CuSO4
- 21. Соли меди (II) сильных кислот подвергаются в водных растворах значительному гидролизу. Катион находится в гидратированном состоянии:
- 22. Комплексные соединения меди (II) с аммиаком, аминокислотами, многоатомными спиртами. [Cu(NH3)4](OH)2 Свойство Сu (ΙΙ) реагировать с белками
- 23. Серебро. Серебро Ag - тяжелый пластичный металл с характерным блеском, Тпл = 962°С, обладает наибольшей среди
- 24. Химические свойства
- 25. Является малоактивным (благородным) металлом, непосредственно не взаимодействует с О2, не реагирует с разбавленными растворами НСl, H2SO4
- 26. 2Ag + Cl2 = 2AgCl; 4Ag + 2SO2 + 2O2 = 2Ag2SO4; (>450°C) 2Ag + H2S
- 27. Оксид серебра Ag2O - твердое вещество темно-коричневого цвета, разлагается при нагревании, проявляет основные свойства, плохо растворяется
- 28. 2Ag2O = 4Ag + О2; (150°С) Ag2O + 4NH4OH = 2[Ag(NH3)2]OH + ЗН2О; Ag2O + 2НNО3(разб)
- 29. Соли серебра. Соли серебра не растворимы в воде, исключение составляют AgF, AgNO3, AgClO3, AgClO4. Взаимодействие с
- 30. качественная реакция на хлорид-ион: HCl + AgNO3 → AgCl↓ + HNO3 NaCl + AgNO3 → AgCl↓
- 31. качественная реакция на бромид-ион: NaBr + AgNO3 → AgBr↓ + NaNO3 AgBr + 2NH3 • H2O
- 32. качественная реакция на иодид-ион: NaI + AgNO3 → AgI↓ + NaNO3 AgI + 2NH3 • H2O
- 33. Химические основы применения соединений серебра в качестве лечебных препаратов в фармацевтическом анализе Растворимые соли серебра, попадая
- 34. Вода, содержащая ионы серебра порядка 10-8 ммоль/л, обладает бактерицидным действием, что обусловлено образованием нерастворимых альбуминатов. Эффективность
- 35. Золото Au – желтый, ковкий, тяжелый металл, Тпл = 1064°С, благородный металл. Нахождение в природе. Встречается
- 36. Химические свойства
- 37. Не реагирует с водой, кислотами, щелочами, кислородом, азотом, углеродом, серой. Переводится в раствор "царской водкой", со
- 38. Au + НNО3(конц) + 4НСl(конц) = H[AuCl4] + NO + 2H2О; 2Au + 3Сl2 = 2AuCl3
- 39. Оксид и гидроксид золота (III) нерастворимы в воде, проявляют амфотерные свойства: Au(OH)3 + 3HCl = AuCl3
- 40. Соединения Au (III) проявляют окислительные свойства: Подобрать коэффициенты: AuCl3 + H2O2 (конц.) → Au (коллоид) +O2
- 42. Скачать презентацию
![Общая характеристика группы. 28Cu − 1s22s22p63s23p63d104s1; [Ar] 3d104s1 47Ag − 1s22s22p63s23p63d104s24p64d105s1;](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1253029/slide-1.jpg)









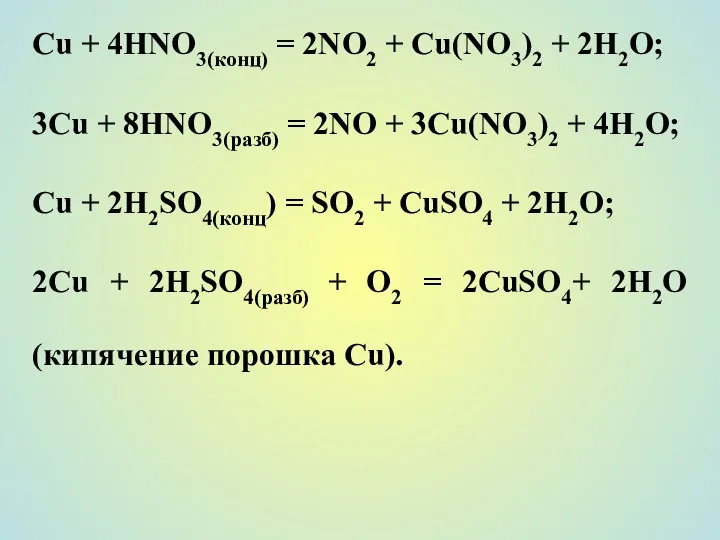








2 Свойство](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1253029/slide-21.jpg)



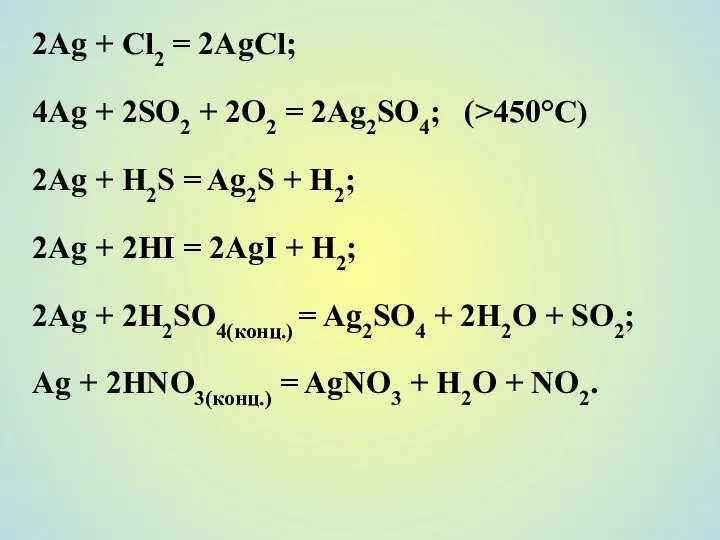

![2Ag2O = 4Ag + О2; (150°С) Ag2O + 4NH4OH = 2[Ag(NH3)2]OH](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1253029/slide-27.jpg)









![Au + НNО3(конц) + 4НСl(конц) = H[AuCl4] + NO + 2H2О;](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1253029/slide-37.jpg)


 Цікаві факти про Харчові добавки Презентація Гладкіх Ксенії Учениці 11-В класу
Цікаві факти про Харчові добавки Презентація Гладкіх Ксенії Учениці 11-В класу  Кинетика сложных реакций
Кинетика сложных реакций Карбоновые кислоты
Карбоновые кислоты Аккумуляторы и их устройство
Аккумуляторы и их устройство Химическое равновесие. Протолитические равновесия и процессы в растворах электролитов
Химическое равновесие. Протолитические равновесия и процессы в растворах электролитов Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений Оксиды. Определение, состав, номенклатура, классификация и структурные формулы
Оксиды. Определение, состав, номенклатура, классификация и структурные формулы Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Минералы. Значение минералов и задачи минералогии
Минералы. Значение минералов и задачи минералогии Взаимодействие плазмы с поверхностью. Проблемы термоядерного реактора
Взаимодействие плазмы с поверхностью. Проблемы термоядерного реактора Спирты. Классификация спиртов
Спирты. Классификация спиртов Лужні метали Підготувала: Анна Сідорова
Лужні метали Підготувала: Анна Сідорова  Загрязнение продуктов питания примесями, мигрирующими из оборудования, инвентаря, тары и упаковочных материалов
Загрязнение продуктов питания примесями, мигрирующими из оборудования, инвентаря, тары и упаковочных материалов Поліетелен. Застосування поліетилену
Поліетелен. Застосування поліетилену Химический элемент медь
Химический элемент медь Тема урока: Состав, переработка нефти и экологические проблемы связанные с ней.
Тема урока: Состав, переработка нефти и экологические проблемы связанные с ней. Диазины. Характеристика диазинов. (Лекция 8)
Диазины. Характеристика диазинов. (Лекция 8) Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Сульфат меди
Сульфат меди Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды Понятие электродного потенциала и методы его измерения
Понятие электродного потенциала и методы его измерения Путешествие в мир углеводородов нефти
Путешествие в мир углеводородов нефти Звезды Лейденфроста
Звезды Лейденфроста Фотодыхание
Фотодыхание Уголь. Виды угля
Уголь. Виды угля Алюминий и его соединения
Алюминий и его соединения Растворы и их классификация
Растворы и их классификация МЫШЬЯК Презентацию подготовила Юдайханова Юлия Ученица 11 класса В
МЫШЬЯК Презентацию подготовила Юдайханова Юлия Ученица 11 класса В