Содержание
- 2. Неорганические вещества простые сложные
- 3. Простые вещества Простые вещества Металлы (М; Ме) Инертные газы Неметаллы (неМ; неМе)
- 4. Сложные вещества Оксиды Основания Кислоты Соли
- 5. Оксиды Оксиды – это соединения двух элементов, один из которых кислород со степенью окисления -2. Общая
- 6. Классификация оксидов Оксиды Несолеобразующие* Солеобразующие* Основные* Кислотные* Амфотерные * - Выписать определения и примеры (с. 248,
- 7. Номенклатура оксидов Название оксида = «Оксид» + Название элемента в родит. падеже + Валентность элемента (римскими
- 8. Водородные соединения Водородные соединения гидриды Гидриды — соединения водорода с металлами и с имеющими меньшую электроотрицательность,
- 9. Основания Основания – это сложные вещества, молекулы которых состоят из атома металла и одной или нескольких
- 10. Классификация оснований Основания растворимые (щелочи) нерастворимые Таблица растворимости растворимость в воде
- 11. Классификация оснований Основания однокислотные (одна гидроксидная группа) двухкислотные (две гидроксидные группы) Трехкислотные (три гидроксидные группы) по
- 12. Номенклатура оснований Название гиороксида = «Гидроксид» + Название металла в родит. падеже + Валентность элемента (римскими
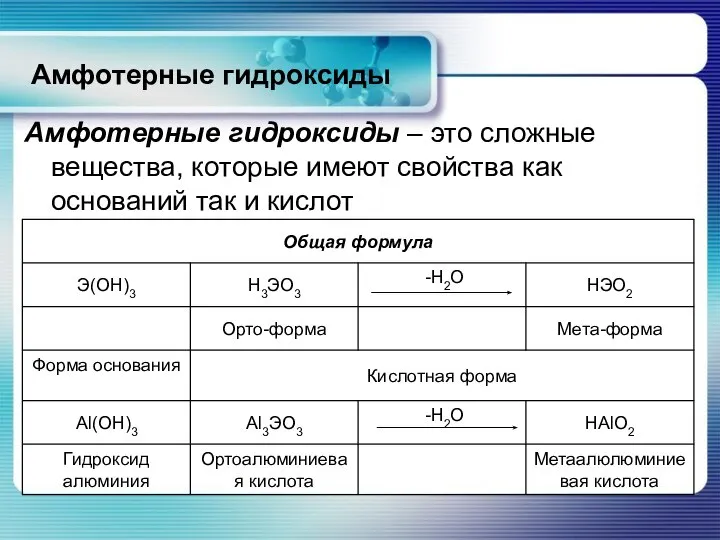
- 13. Амфотерные гидроксиды Амфотерные гидроксиды – это сложные вещества, которые имеют свойства как оснований так и кислот
- 14. Качественными реакциями называют такие реакции, которые позволяют отличить одни вещества от других, а также узнать качественный
- 15. Соли металлов в огне
- 17. Скачать презентацию













 Химические средства защиты растений
Химические средства защиты растений Каталитический крекинг. Промышленные установки
Каталитический крекинг. Промышленные установки Предельные углеводороды
Предельные углеводороды Алюминий және оның қосылыстары
Алюминий және оның қосылыстары Роль хімії в сучасному житті
Роль хімії в сучасному житті Презентация по Химии "Кислотные дожди"
Презентация по Химии "Кислотные дожди" Простые вещества - металлы
Простые вещества - металлы Минерал чароит. Месторождения
Минерал чароит. Месторождения Валериановая кислота
Валериановая кислота Индикатор pH
Индикатор pH Химические реакции
Химические реакции Физические и химические явления
Физические и химические явления Занимательная химия
Занимательная химия Оксид металлов
Оксид металлов Вазелин и вазелиновое масло
Вазелин и вазелиновое масло Щелочноземельные металлы
Щелочноземельные металлы Презентация Химический состав мороженного
Презентация Химический состав мороженного Спирты, фенолы, простые эфиры
Спирты, фенолы, простые эфиры Электролитическая диссоциация уксусной и муравьиной кислоты
Электролитическая диссоциация уксусной и муравьиной кислоты Методы выделения и очистки продуктов биотехнологических производств
Методы выделения и очистки продуктов биотехнологических производств Интересные факты из жизни Дмитрия Ивановича Менделеева
Интересные факты из жизни Дмитрия Ивановича Менделеева  Personal сare. Akypo Foam Rl 40
Personal сare. Akypo Foam Rl 40 Азотная кислота и нитраты
Азотная кислота и нитраты ,1
,1 Катионы І - ІІІ аналитических групп
Катионы І - ІІІ аналитических групп Щавелевая кислота
Щавелевая кислота Установка кристаллов
Установка кристаллов Тугоплавкие металлы и их сплавы
Тугоплавкие металлы и их сплавы