Содержание
- 2. СОДЕРЖАНИЕ Основные понятия Виды коррозии Скорость коррозии Химическая коррозия Электрохимическая коррозия Анодный процесс Катодный процесс Деполяризаторы
- 4. Основные понятия содержание Коррозия металлов - самопроизвольное разрушение металлов и сплавов в результате химического и электрохимического
- 5. содержание Виды коррозии Атмосферная коррозия – коррозия металлов в естественных атмосферных условиях (около 80% металлических конструкций
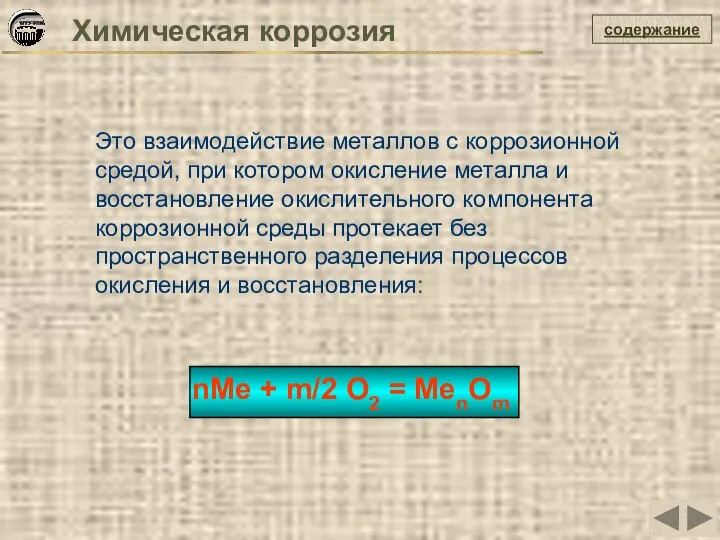
- 8. содержание Химическая коррозия Это взаимодействие металлов с коррозионной средой, при котором окисление металла и восстановление окислительного
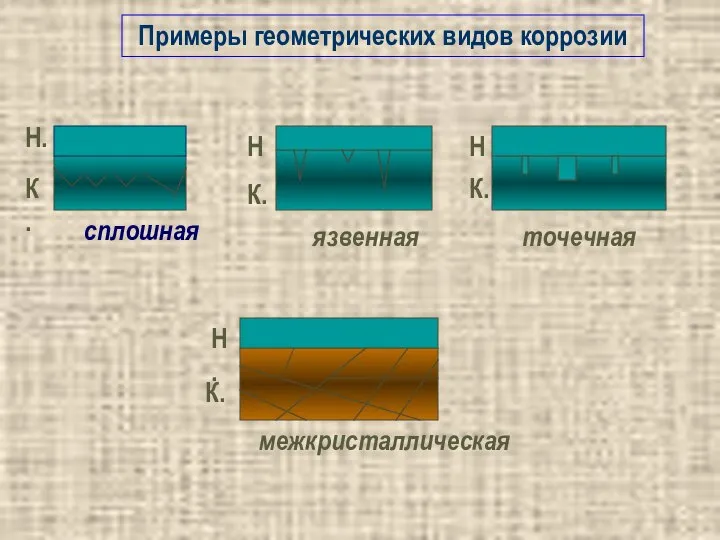
- 12. содержание Местная (локальная коррозия) Сплошная (общая) Равномерная коррозия Неравномерная коррозия Избирательная коррозия Коррозия пятнами Коррозия язвами
- 13. Примеры геометрических видов коррозии точечная межкристаллическая
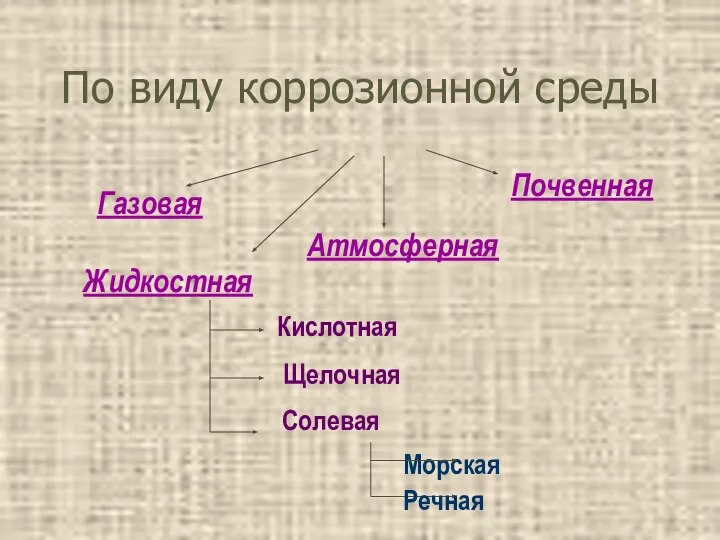
- 14. По виду коррозионной среды Газовая Атмосферная Почвенная Жидкостная Кислотная Щелочная Морская Речная
- 16. Скорость коррозии содержание по изменению массы за единицу времени с единицы поверхности г/м2•год); по изменению толщины
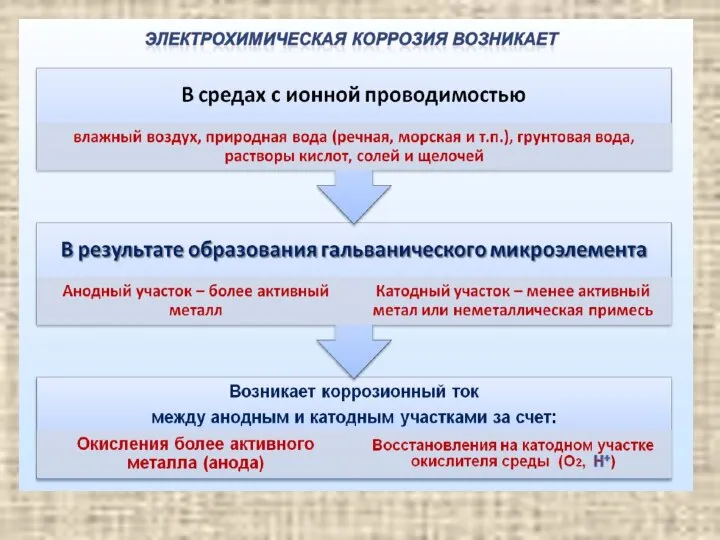
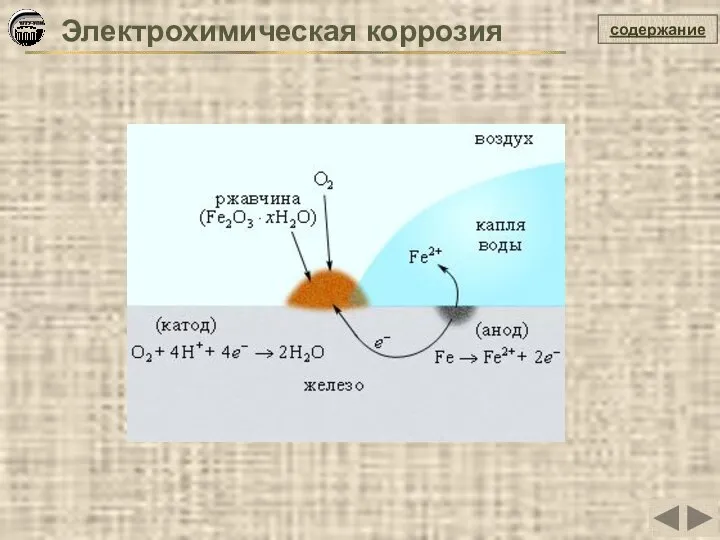
- 17. содержание Электрохимическая коррозия Это самопроизвольное разрушение металлов в присутствии электролитически проводящих сред (раствор или расплав электролита),
- 18. содержание Электрохимическая коррозия
- 19. содержание Причины электрохимической гетерогенности Контакт двух и более металлов с различными потенциалами Контакт металла с различными
- 20. содержание Анодный процесс Me - ne = Men+ ΔGо = – ЕоnF ΔG 0 Самопроизвольный процесс
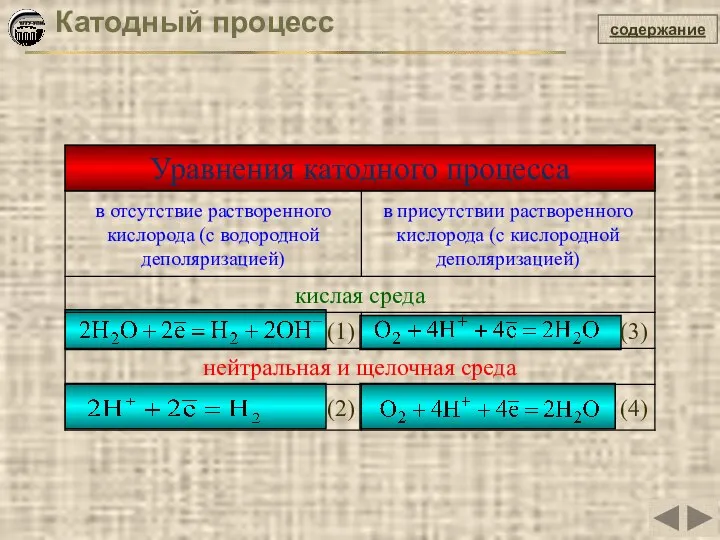
- 21. содержание Катодный процесс
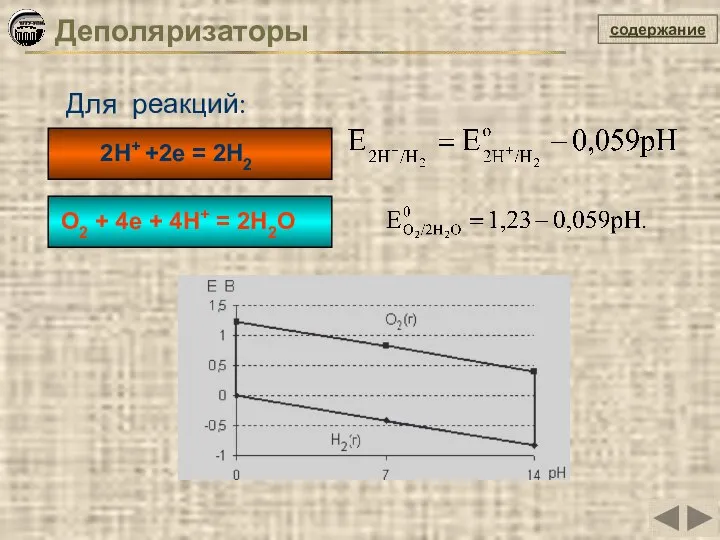
- 22. содержание Для реакций: O2 + 4e + 4H+ = 2H2O Деполяризаторы 2H+ +2e = 2H2
- 24. содержание Катодный процесс Коррозия металлов с водородной деполяризацией Схема катодного процесса с водородной деполяризацией
- 25. содержание Катодный процесс Коррозия металлов с водородной деполяризацией = - 0,059рН Для кислой среды Для нейтральной
- 26. содержание Катодный процесс Коррозия металлов с водородной деполяризацией протекает в следующих условиях: для большинства металлов в
- 27. содержание Катодный процесс Коррозия металлов с кислородной деполяризацией Схема катодного процесса с кислородной деполяризацией
- 28. содержание Коррозия металлов с кислородной деполяризацией Катодный процесс Для кислой среды Для нейтральной среды Для щелочной
- 29. содержание Поляризация электродных процессов Изменение потенциала электрода при прохождении тока называется поляризацией: ΔЕ = Еi –
- 32. содержание Анодная (А) и катодная (К) поляризационные кривые К Поляризация электродных процессов
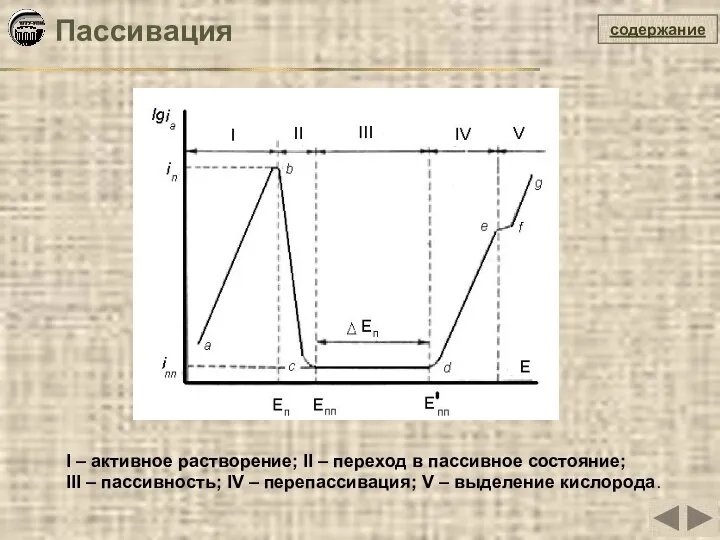
- 33. содержание Пассивация I – активное растворение; II – переход в пассивное состояние; III – пассивность; IV
- 34. Выводы и заключения содержание Электрохимическая коррозия протекает через сопряженные процессы анодного растворения металла и катодного восстановления
- 36. Скачать презентацию

























 Презентация по Химии "Галогени" - скачать смотреть бесплатно
Презентация по Химии "Галогени" - скачать смотреть бесплатно Презентація на тему: “Мінеральні добрива” Підготував: Учень 10-А класу Матвійчук Роман
Презентація на тему: “Мінеральні добрива” Підготував: Учень 10-А класу Матвійчук Роман  Обучающий тест «Виды химической связи»
Обучающий тест «Виды химической связи» Определение исходного металла. Решение задачи алгебраическим методом. Исайкин Александр Михайлович учитель химии МОУ «СОШ
Определение исходного металла. Решение задачи алгебраическим методом. Исайкин Александр Михайлович учитель химии МОУ «СОШ  ОКСИДИ – це бінарні сполуки , що складаються з двох елементів , одним з яких є Оксиген . Загальна формула оксидів : E2On n – вале
ОКСИДИ – це бінарні сполуки , що складаються з двох елементів , одним з яких є Оксиген . Загальна формула оксидів : E2On n – вале Физические и химические свойства аренов
Физические и химические свойства аренов Угарный газ
Угарный газ Радиоактивность
Радиоактивность Классификация материалов
Классификация материалов Все о чае
Все о чае  Презентация по Химии "ПОЖАРНАЯ БЕЗОПАСНОСТЬ" - скачать смотреть бесплатно
Презентация по Химии "ПОЖАРНАЯ БЕЗОПАСНОСТЬ" - скачать смотреть бесплатно Увлекательная химия
Увлекательная химия Соединения галогенов
Соединения галогенов Общие способы получения металлов
Общие способы получения металлов Свойства серной кислоты и солей
Свойства серной кислоты и солей Оксиды, их свойства, получение
Оксиды, их свойства, получение Разгадай ребус
Разгадай ребус  Жевательная резинка польза или вред
Жевательная резинка польза или вред Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда
Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда Некоторые аспекты физической и коллоидной химии
Некоторые аспекты физической и коллоидной химии Урок повторения по химии за курс 8 класса
Урок повторения по химии за курс 8 класса Кислоты вокруг нас
Кислоты вокруг нас Углероды: их роль и значение в жизни человека
Углероды: их роль и значение в жизни человека Вольтамперометрия
Вольтамперометрия Краткий очерк истории развития химии
Краткий очерк истории развития химии Способы количественного определения белка
Способы количественного определения белка Катаболизм жирных кислот. Метаболизм кетоновых тел. (Лекция 8)
Катаболизм жирных кислот. Метаболизм кетоновых тел. (Лекция 8) Классификация высокомолекулярных соединений
Классификация высокомолекулярных соединений