Содержание
- 2. Содержание Основные определения Окислительно-восстановительные реакции Степень окисления. Расчет степени окисления Возможные степени окисления элементов Окислитель и
- 3. Две группы химических реакций реакции, в которых степень окисления атомов, входящих в состав реагирующих веществ, не
- 4. заряд, который имел бы атом при условии, что каждая общая электронная пара полностью смещена к более
- 5. Правила расчета степени окисления Алгебраическая сумма степеней окисления атомов в молекуле равна нулю, в ионе –
- 6. Примеры расчета степени окисления Расчет с. о. марганца в манганате калия K2MnO4 Степень окисления калия равна
- 7. Возможные высшая и низшая степени окисления металлов Номер группы в периодической системе равен числу валентных электронов
- 8. Возможные высшая и низшая степени окисления неметаллов Высшая степень окисления равна номеру группы, за исключением кислорода
- 9. Окислитель и восстановитель, окисление и восстановление Восстановитель − частица (атом, молекула, ион), которая отдает электроны. Восстановитель
- 10. Окислительно-восстановительные свойства соединений Только окислителями являются: простые вещества, атомы которых имеют самую большую электроотрицательность − фтор
- 11. Окислительно-восстановительные свойства соединений И окислителями, и восстановителями могут быть: простые вещества − неметаллы, кроме фтора и
- 12. Типы окислительно-восстановительных реакций Межмолекулярные реакции окисления−восстановления протекают с изменением степени окисления атомов в разных веществах Внутримолекулярные
- 13. Типы окислительно-восстановительных реакций Реакции диспропорционирования (самоокисления −самовосстановления) протекают с одновременным уменьшением и увеличением степени окисления атомов
- 14. Заключение Окислительно-восстановительные реакции − реакции, в которых изменяются степени окисления атомов, входящих в состав реагирующих веществ
- 16. Скачать презентацию













 ПРЕЗЕНТАЦИЯ «Химия и повседневная жизнь человека»
ПРЕЗЕНТАЦИЯ «Химия и повседневная жизнь человека»  Видатні вітчизняні хіміки
Видатні вітчизняні хіміки Альдегиды и кетоны
Альдегиды и кетоны Дизельное топливо
Дизельное топливо Презентация по Химии "Применение алюминия и его сплава" - скачать смотреть
Презентация по Химии "Применение алюминия и его сплава" - скачать смотреть  Химический аквариум или живое из неживого
Химический аквариум или живое из неживого Общая характеристика металлов
Общая характеристика металлов Кобальт. Химический элемент
Кобальт. Химический элемент Презентация на тему «Металлы и сплавы в моей профессии. Антикоррозийные покрытия»
Презентация на тему «Металлы и сплавы в моей профессии. Антикоррозийные покрытия»  Углерод
Углерод Колебания кристаллической решетки и ее тепловые свойства. Динамика решетки
Колебания кристаллической решетки и ее тепловые свойства. Динамика решетки Традиции и обычаи Узбекистана Национальные обряды, игры, праздники
Традиции и обычаи Узбекистана Национальные обряды, игры, праздники Презентация по Химии "Химия неметаллов. Общая характеристика" - скачать смотреть
Презентация по Химии "Химия неметаллов. Общая характеристика" - скачать смотреть  Простой борный суперфосфат
Простой борный суперфосфат Нафта: склад,властивості, основні процеси переробки,застосування
Нафта: склад,властивості, основні процеси переробки,застосування  Массовая доля растворённого вещества
Массовая доля растворённого вещества Получение армированных фотополимерных композиций
Получение армированных фотополимерных композиций Презентация по Химии "Синтетичні мийні засоби" - скачать смотреть бесплатно
Презентация по Химии "Синтетичні мийні засоби" - скачать смотреть бесплатно Посвящение в химики. Игра-викторина. Внеклассное мероприятие по химии для учащихся 8 классов.
Посвящение в химики. Игра-викторина. Внеклассное мероприятие по химии для учащихся 8 классов.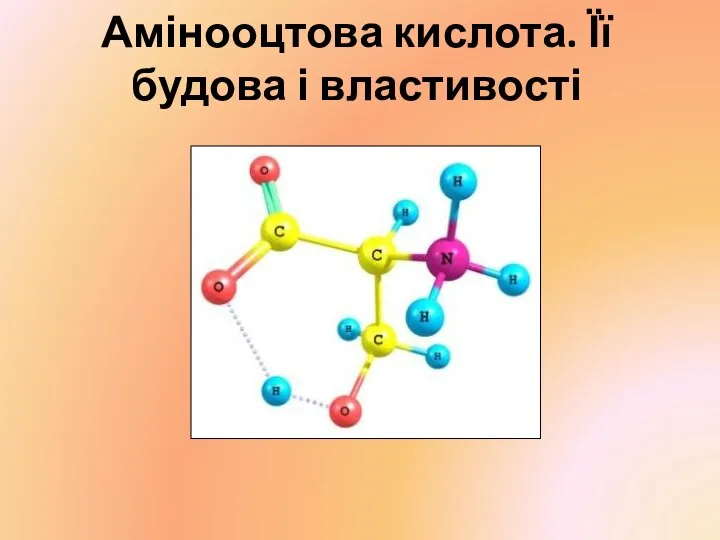 Амінооцтова кислота. Її будова і властивості
Амінооцтова кислота. Її будова і властивості Методы исследования белковых молекул
Методы исследования белковых молекул Именные реакции в органической химии. Органический синтез. Механизмы химических процессов
Именные реакции в органической химии. Органический синтез. Механизмы химических процессов Ph воды
Ph воды Нуклеопротеины
Нуклеопротеины Углеводы. Структура
Углеводы. Структура Спирты: свойства, получение, применение
Спирты: свойства, получение, применение Колоїдна хімія
Колоїдна хімія Химические свойства хрома
Химические свойства хрома