Содержание
- 2. Комплексометрическое титрование, или комплексометрия - В методе комплексометрического титрования выделяют такие методы: меркуриметрия фторидометрия цианидометрия комплексонометрия
- 3. Требования к реакциям в комплексометрии: Реакция должна протекать стехиометрически. Реакция должна протекать количественно и до конца,
- 4. В меркуриметрии используют образование галогенидных и псевдогалогенидных комплексов Hg(II). В условиях титрования протекает реакция: 2Cl- +
- 5. Меркуриметрия Титрант: вторичный стандартный раствор Hg(NO3)2 Стандартизация: по первичному стандартному раствору натрий хлорида NaCl: Hg(NO3)2 +
- 6. Индикаторы: 1. раствор натрий пентацианонитрозоферрата (ІІІ) (натрий нитропруссид) Na2[Fe(CN)5NO], который образует с Hg2+-ионами малорастворимую белую соль:
- 7. Меркуриметрическое определение йодидов базируется на реакции: Hg2+ + 4I- = [HgI4]2- В т.э.: [HgI4]2- + Hg2+
- 8. Определение роданидов (тиоцианатов SCN-): как индикатор используют раствор соли Fe(III) До т.э.: Fe3+ + 3SCN- =
- 9. Определение солей меркурия (ІІ): титрант - раствор калий тиоцианата, индикатор - ионы Fe(III). В точке эквивалентности
- 10. Фторидометрия Титрант: перв. станд. раствор NaF Определяемые ионы: алюминий, цирконий, торий, кальций. Реакции: Al3+ + 6F-
- 11. Индикаторы: кислотно-основные (метиловый оранжевый), поскольку реакция растворов - кислая: Al3+ + HOH = AlOH2+ + H+
- 12. Цианидометрия Титрант: втор. станд. р-р калий цианида KCN Стандартизация: по станд. раст. AgNO3: Ag+ + 2CN-
- 13. Реакция метода: [Ni(NH3)4]2+ + 4CN- = [Ni(CN)4]2- + 4NH3 Среда: щелочная (аммиачная) Индикаторы: суспензия аргентум йодида
- 14. Комплексонометрия Комплексон І: нитрилтриацетатная кислота (тетрадентатный)
- 15. Комплексон ІІ: этилендиамминтетра-ацетатная кислота (ЭДТА) Комплексон ІІІ: этилендиамминтетраацетат натрия (Na-ЭДТА, трилон Б, хелатон) - Na2H2Y
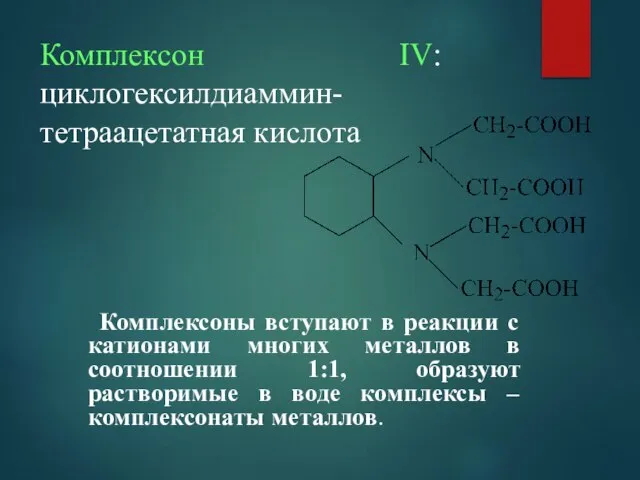
- 16. Комплексон ІV: циклогексилдиаммин-тетраацетатная кислота Комплексоны вступают в реакции с катионами многих металлов в соотношении 1:1, образуют
- 17. Преимущества использования комплексонов хорошо растворимы в воде и некоторых других органических растворителях повышенная устойчивость комплексов реакции
- 18. Комплексонометрия Титрант: 0,05 моль/л раствор натрий эдетата Стандартизация титранта за веществами: Zn + H2SO4 → ZnSO4
- 19. Комплексонометрия Индикаторы: металлохромные Общая реакция метода: Men+ + H2Y2- → MeYn-4 + 2H+ Men+ + Y4-
- 20. Условные константы устойчивости
- 21. Зависимость мольной доли эдетат-иона от рН среды
- 22. Условия комплексонометрического титрования высокая устойчивость комплексонатов металлов (βст.) придерживание конкретного значения кислотности среды использование буферных растворов
- 23. Прямое комплексонометрическое титрование Условия использования: высокая скорость реакции реакция проходит количественно, стехиометрически, до конца есть индикатор,
- 24. Способы повышения селективности прямого титрования: Регулирование рН среды ионы Fе3+, Ga3+, In3+, Tl3+, Ві3+, ZrIV, ТhIV
- 25. Обратное комплексонометрическое титрование Условия использования: невозможно выбрать индикатор реакция проходит медленно если при данном рН раствора,
- 26. Дополнительные титранты: соли Zn2+ или Мg2+ Ме1х+ + Н2Y2- ↔ Ме1Yх-4 + 2Н+ определ. ион избыток
- 27. Обратное комплексонометрическое титрование и определение анионов SO42- + Ba2+ ↔ BaSO4↓ определ. ион избыток Ba2+ +
- 28. Непрямое комплексонометрическое титрование Условия использования: образование очень устойчивых комплексов с индикатором отсутствие индикатора для определения анионов
- 29. Непрямое комплексонометрическое титрование Меn+ + МgY2- ↔ МеYn-4 + Мg2+ определ. вещ. заместитель Мg2+ + Н2Y2-
- 30. РО43- + Мg2+ + NH4+↔ МgNH4РО4↓ определ. вещ. осадок определ. вещ. МgNH4РО4↓+Н+↔HРО42-+Мg2++NH4+ осадок определ. вещ. заместитель
- 31. Требования к индикаторам в комплексонометрии металл и индикатор должны давать комплекс в соотношении 1:1 окраска индикатора
- 32. Металлоиндикаторы сами не окрашены металлохромные специфические: Fe3+ - сульфосалициловая сами окрашены, поскольку кислота (красная окраска) имеют
- 33. Механизм изменения окраски металлохромных индикаторов Me2+ + Іnd ⇔ MeІnd- синий красный MeІnd + H2Y2- ⇔
- 36. Скачать презентацию




![Индикаторы: 1. раствор натрий пентацианонитрозоферрата (ІІІ) (натрий нитропруссид) Na2[Fe(CN)5NO], который образует](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/522739/slide-5.jpg)
![Меркуриметрическое определение йодидов базируется на реакции: Hg2+ + 4I- = [HgI4]2-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/522739/slide-6.jpg)





![Реакция метода: [Ni(NH3)4]2+ + 4CN- = [Ni(CN)4]2- + 4NH3 Среда: щелочная](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/522739/slide-12.jpg)




















 Свойства простых веществ 8 класс
Свойства простых веществ 8 класс Элементы равновесной электрохимии, ионоселективные электроды
Элементы равновесной электрохимии, ионоселективные электроды Соединения алюминия
Соединения алюминия Алканы. Физические и химические свойства
Алканы. Физические и химические свойства Физическая технология топлива. Направления переработки нефти. Классификация нефтепродуктов
Физическая технология топлива. Направления переработки нефти. Классификация нефтепродуктов Презентация по химии Амины
Презентация по химии Амины Презентация по Химии "Самодельная грелка" - скачать смотреть
Презентация по Химии "Самодельная грелка" - скачать смотреть  Общие представления об электрохимических технологиях
Общие представления об электрохимических технологиях Смазочные материалы. Моторные масла
Смазочные материалы. Моторные масла ИЗОМЕРИЯ И СТРОЕНИЕ КС. СПОСОБНОСТЬ АТОМОВ РАЗЛИЧНЫХ ЭЛЕМЕНТОВ К КОМПЛЕКСООБРАЗОВАНИЮ. УСТОЙЧИВОСТЬ КС Лектор: канд. хим. н
ИЗОМЕРИЯ И СТРОЕНИЕ КС. СПОСОБНОСТЬ АТОМОВ РАЗЛИЧНЫХ ЭЛЕМЕНТОВ К КОМПЛЕКСООБРАЗОВАНИЮ. УСТОЙЧИВОСТЬ КС Лектор: канд. хим. н Изучение слёзного аппарата человека, функций плача и состав слёз
Изучение слёзного аппарата человека, функций плача и состав слёз Физические свойства полимеров
Физические свойства полимеров Общая характеристика элементов VIA-группы (халькогены). Сера. Кислород
Общая характеристика элементов VIA-группы (халькогены). Сера. Кислород Анализ пищевых добавок (маркировка Е) используемых в продуктовой линейке Витамакс
Анализ пищевых добавок (маркировка Е) используемых в продуктовой линейке Витамакс Определение предмета биофизики
Определение предмета биофизики Органічна хімія
Органічна хімія Гелий. Физико-химические свойства
Гелий. Физико-химические свойства Алканы. Алканы.
Алканы. Алканы. Заттардың агрегаттық күйлері
Заттардың агрегаттық күйлері Скорость химических реакций. Факторы, влияющие на скорость химических реакций
Скорость химических реакций. Факторы, влияющие на скорость химических реакций Хлороводород..Соляная кислота
Хлороводород..Соляная кислота Применение дидактических игр на уроках химии
Применение дидактических игр на уроках химии Определение исходного металла. Решение задачи алгебраическим методом. Исайкин Александр Михайлович учитель химии МОУ «СОШ
Определение исходного металла. Решение задачи алгебраическим методом. Исайкин Александр Михайлович учитель химии МОУ «СОШ  Нуклеофильное замещение галогена и других функциональных групп
Нуклеофильное замещение галогена и других функциональных групп 140 лет дому, который построил Д.И. Менделеев
140 лет дому, который построил Д.И. Менделеев Сера
Сера Растворы. Способы выражения концентрации растворенного вещества
Растворы. Способы выражения концентрации растворенного вещества Презентация Элементы таблицы Менделеева
Презентация Элементы таблицы Менделеева