Методика обучения решению заданий ОГЭ по теме Степень окисления. Окислительно-восстановительная реакция
Содержание
- 2. Цель Рассмотреть этапы формирования у обучающихся навыка определения степеней окисления элементов и уравнивания окислительно-восстановительных реакций методом
- 3. Степень окисления условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи
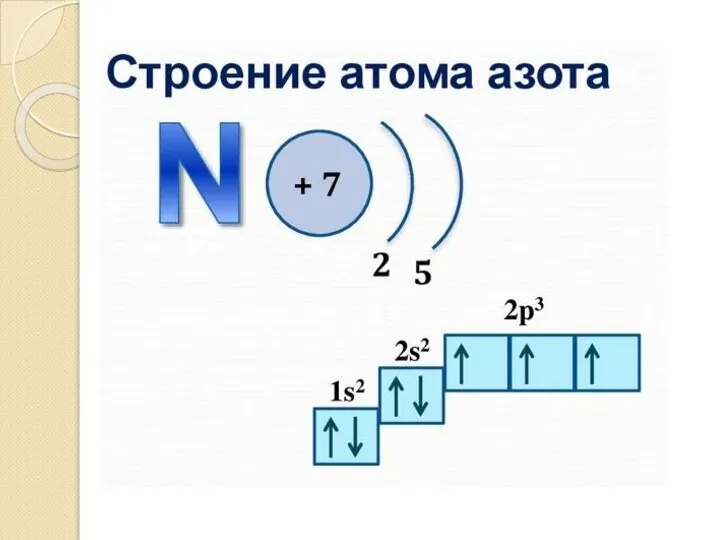
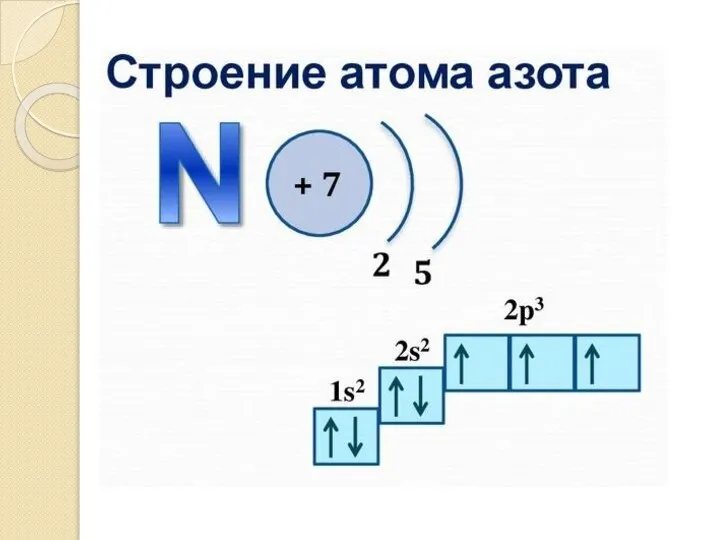
- 5. Строение атома серы
- 6. Электроотрицательность Свойство атомов данного элемента оттягивать на себя электроны от атомов других элементов в соединениях. На
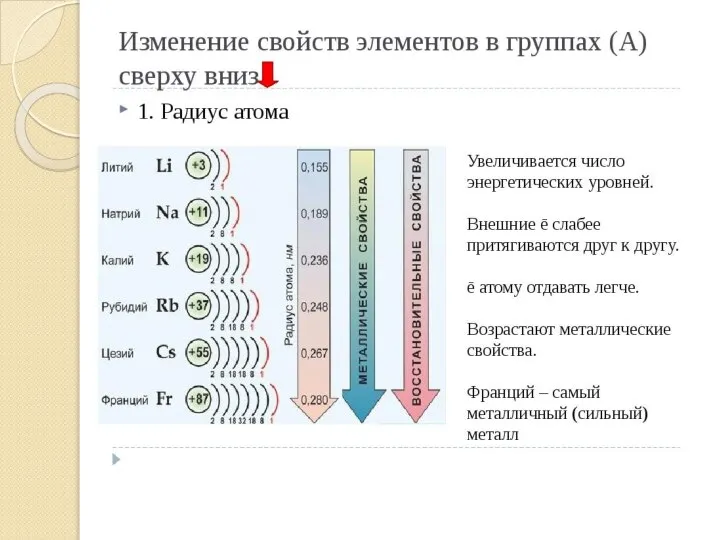
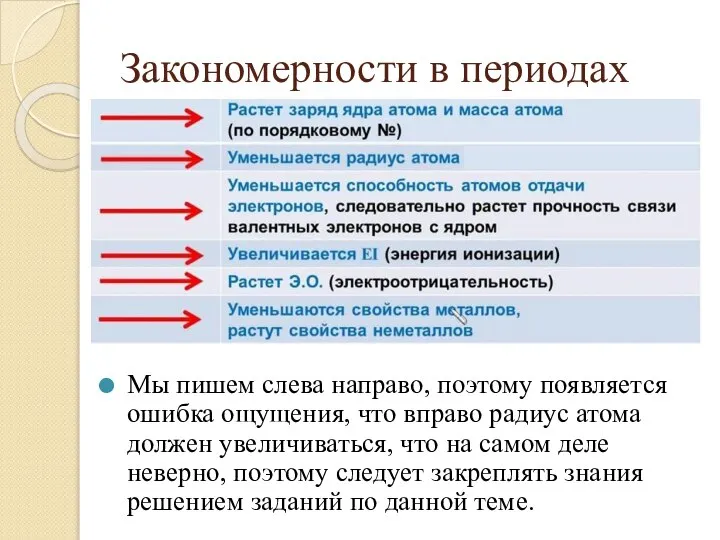
- 8. Закономерности в периодах Мы пишем слева направо, поэтому появляется ошибка ощущения, что вправо радиус атома должен
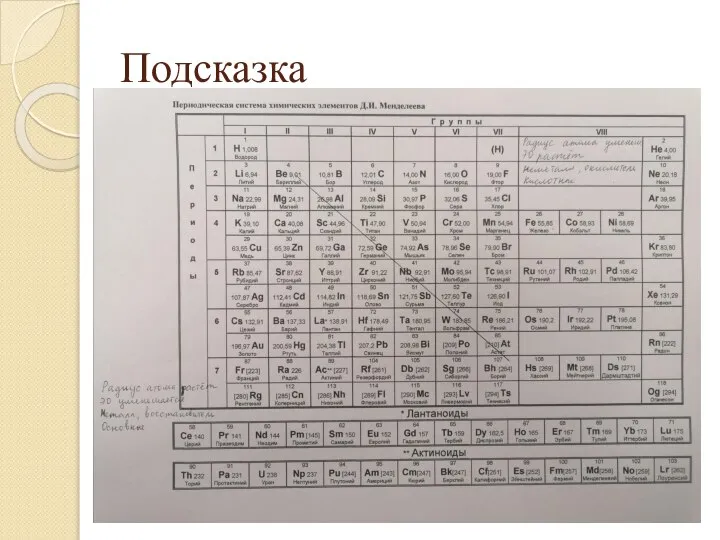
- 9. Подсказка
- 10. Химическая связь
- 11. Степень окисления условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи
- 12. Основные этапы формирования понятия «степень окисления» Строение атома Электроотрицательность Закономерности изменения свойств в группах и периодах
- 13. Правила определения степеней окисления Постоянная степень окисления фтора F-1 Постоянная степень окисления водорода H+1. Но: Na+1H-1,
- 14. Правила определения степеней окисления Степень окисления простых веществ равна нулю: Cl20, F20, Fe0 (У простых веществ
- 15. Соединения меди, серебра и золота Делают ошибки в определении степеней окисления меди в соединениях СuSO4, CuNO3
- 16. Правила определения степеней окисления Степень окисления кислотного остатка постоянна. CuSO4 образован H2SO4, расставив степени в которой
- 17. Правила определения степеней окисления Элементы- неметаллы с IV группы имеют переменную степень окисления: - высшая (максимальная)
- 18. Правила определения степеней окисления Металлы во всех сложных соединениях имеют только положительные степени окисления. (В соединениях
- 19. Нахождение степеней окисления элементов в бинарных соединениях Краткий алгоритм: Ставим степень окисления у того атома, в
- 20. Способы нахождения степеней окисления элементов в сложных соединениях, которые содержат более трех элементов. Алгебраический Графический
- 21. Типы заданий (№4, повышенный уровень, 2 балла) Решение заданий начинаем от простого к сложному: Степень окисления
- 22. Типы заданий (№4) Высшая и низшая степень окисления фосфора соответственно равны: 1)-3 и +5 2)+3 и
- 23. Типы заданий (№4) Степень окисления и валентность азота в N2O5 соответственно равны: 1)-5 и V 2)+5
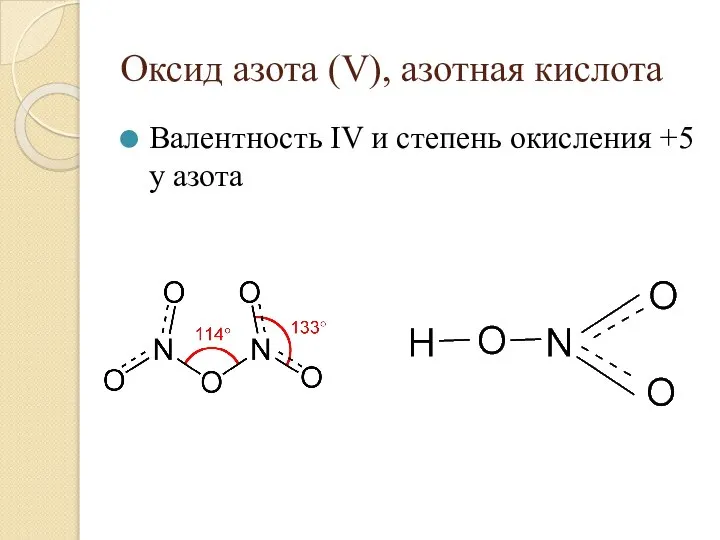
- 25. Оксид азота (V), азотная кислота Валентность IV и степень окисления +5 у азота
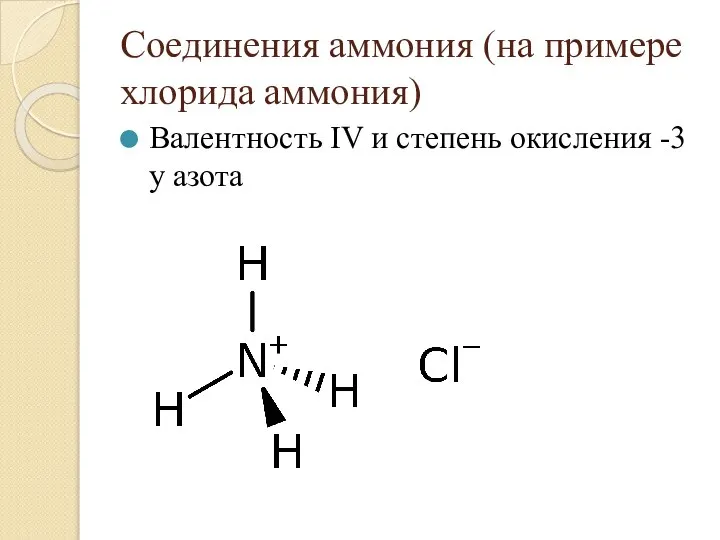
- 26. Соединения аммония (на примере хлорида аммония) Валентность IV и степень окисления -3 у азота
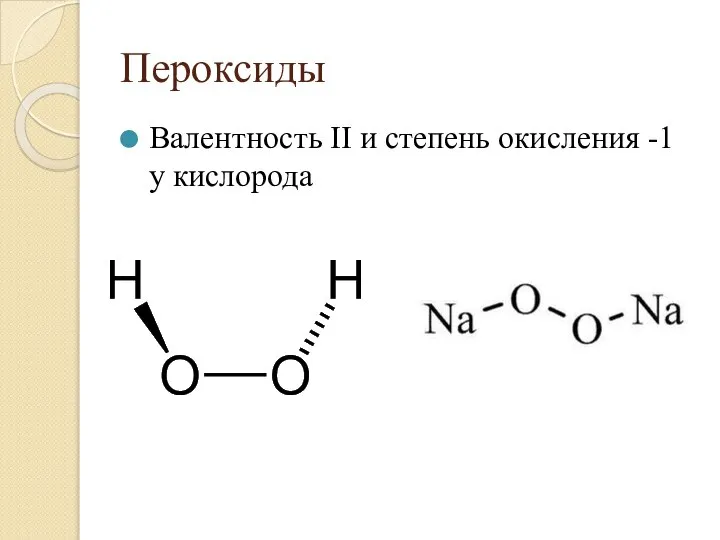
- 27. Пероксиды Валентность II и степень окисления -1 у кислорода
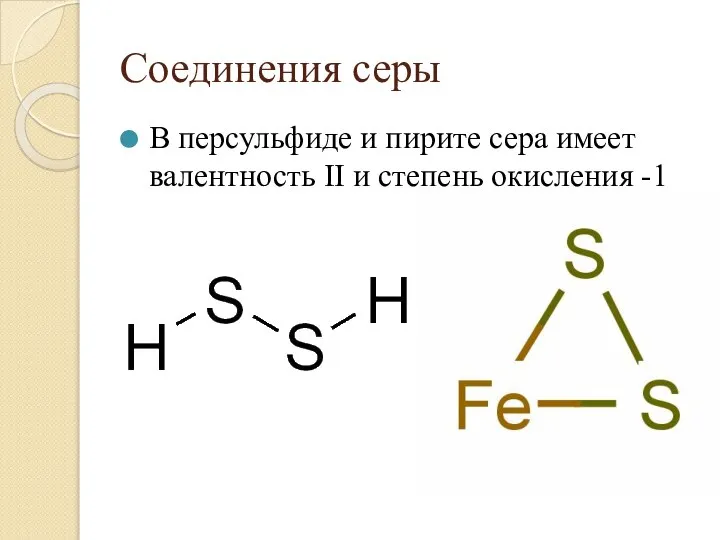
- 28. Соединения серы В персульфиде и пирите сера имеет валентность II и степень окисления -1
- 29. Типичные ошибки Неверно определена степень окисления атомов: например, у простого вещества определили степень окисления, как у
- 30. Задание №15 и 20 В задании номер 15 предлагается определить процесс окисления или восстановления, выбрать окислительно-восстановительную
- 31. Задание №20 (ОВР, высокий уровень, 3 балла) Алгоритм: 1. Переписать схему реакции (часто нитриты и сульфиты
- 32. Подсказка для составления полуреакций (схемы перехода электронов) 4. Составить полуреакции (схемы переходов электронов). 5. Определить НОК
- 33. Подсказка для определения окислителя и восстановителя ВВО – взял, восстановился, является окислителем. ООВ – отдал, окислился,
- 34. Пример оформления В данном случае Сu0 – восстановитель, N+5 или HNO3 – окислитель. Можно использовать вариант
- 35. Как найти у себя ошибку? Отложить задание. Проверить, верно ли записана схема реакции. (Часто «теряют» индексы
- 36. Задание №20 Начинаем с простых уравнений, чтобы у обучающихся сформировался навык уравнивания и они чувствовали уверенность
- 37. Задание №20 (примеры) Для закрепления навыка: Zn+ HNO3→Zn(NO3)2+NO2+H2O Mg+ HNO3→Mg(NO3)2+NO+H2O C+HNO3→CO2+NO2+H2O P+H2SO4 →H3PO4+SO2 PH3+H2SO4 →H3PO4+SO2+H2O
- 38. Задание №20 Далее, для усложнения мы берем реакции, в которых элементы встречаются в составе нескольких веществ,
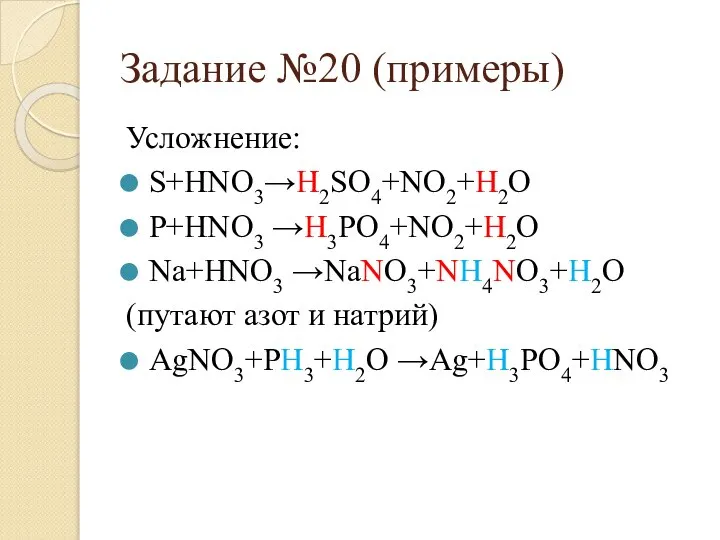
- 39. Задание №20 (примеры) Усложнение: S+HNO3→H2SO4+NO2+H2O P+HNO3 →H3PO4+NO2+H2O Na+HNO3 →NaNO3+NH4NO3+H2O (путают азот и натрий) AgNO3+PH3+H2O →Ag+H3PO4+HNO3
- 40. Задание №20 Далее, мы берем уравнения, в которых встречаются двухатомные молекулы простых веществ, в которых нужно
- 41. Задание №20 После, берем реакции, в которых индекс учитывается у атомов, входящих в состав сложного вещества.
- 42. Задание №20 Диспропорционирование: Cl2+KOH →KCl+KClO3+H2O NO2+NaOH →NaNO2+NaNO3+H2O KClO3 →KCl+KClO4 Некоторые не могут найти вторую пару для
- 43. Типичные ошибки Неверно расставлены коэффициенты в уравнении реакции, потому что: Неверно подсчитано НОК; Вместо коэффициентов взяты
- 44. Типичные ошибки Степени окисления (N+5O3-2) записаны как заряды ионов (N5+O32-) В полуреакциях у атомов элементов, входящих
- 45. Типичные ошибки Неверно определен окислитель и восстановитель (наоборот). Неверно определено, какой элемент принял, а какой –
- 46. Задание №15 (базовый уровень, 1 балл) Самый простой тип – определить в схеме процесс окисления или
- 47. Задание №15 Установите соответствие между уравнением реакции и ролью водорода в ней: A)3H2+N2 →2NH3 Б)H2O2+2KI →2KOH+I2
- 48. Задание №15 Выберите три реакции, которые относятся к окислительно-восстановительным. Выберите три реакции, в которых один и
- 49. Задание №15 Выберите три реакции, в которых нитрат серебра является окислителем: 1. AgNO3+Fe → 2. AgNO3+KOH
- 50. Задание №15 Установите соответствие между схемой процесса и веществом-восстановителем в нём, происходящего в окислительно-восстановительной реакции: A)Cl2+F2
- 51. Задание №15 Выберите три вещества, при взаимодействии с которыми водород является окислителем: 1) Хлор 2) Литий
- 52. Типичные ошибки Неверно расставлены степени окисления. Обучающиеся не различают понятия «окисление» - «окислитель», «восстановление» - «восстановитель»
- 53. «Никогда не ошибается тот, кто ничего не делает» Теодор Рузвельт
- 55. Скачать презентацию










































 Изучение возможности синтеза порошка сложного карбонитрида -титана молибдена Ti-Mo в режиме СВС
Изучение возможности синтеза порошка сложного карбонитрида -титана молибдена Ti-Mo в режиме СВС Методы получения основных классов неорганических соединений
Методы получения основных классов неорганических соединений Исследование условий образования внутренних тангенциальных азеотропов в бинарных двухфазных системах
Исследование условий образования внутренних тангенциальных азеотропов в бинарных двухфазных системах Кислоты органические и неорганические.
Кислоты органические и неорганические. Реологические свойства полимеров
Реологические свойства полимеров Презентация по Химии "Портфоліо" - скачать смотреть
Презентация по Химии "Портфоліо" - скачать смотреть  Химические свойства воды
Химические свойства воды Гормоны
Гормоны  Растворы. Классификация дисперсных систем
Растворы. Классификация дисперсных систем Презентация по Химии "Охорона навколишнього середовища під час виробництва і використання металів" - скачать смотреть беспла
Презентация по Химии "Охорона навколишнього середовища під час виробництва і використання металів" - скачать смотреть беспла Введение в термические процессы вторичной переработки нефти
Введение в термические процессы вторичной переработки нефти Альдегиды и кетоны
Альдегиды и кетоны Группа нефелиновых сиенитов-фонолитов
Группа нефелиновых сиенитов-фонолитов Основы строения органических соединений. Теория строения органических соединений
Основы строения органических соединений. Теория строения органических соединений Фосфор и его основные соединения
Фосфор и его основные соединения Выполнила учитель химии и экологи МОУ «СОШ с. Усть-Курдюм» Филимонова И.В. 8 класс
Выполнила учитель химии и экологи МОУ «СОШ с. Усть-Курдюм» Филимонова И.В. 8 класс Целестин мінерал Підготувала учениця 8 – А класу Мостєпан Ксенія
Целестин мінерал Підготувала учениця 8 – А класу Мостєпан Ксенія Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота
Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота Технология производства химических волокон. Свойства химических волокон. 7 класс
Технология производства химических волокон. Свойства химических волокон. 7 класс Научно – исследовательская работа «Газированная вода - вред или польза?»
Научно – исследовательская работа «Газированная вода - вред или польза?» Растворы (дисперсные системы)
Растворы (дисперсные системы) Натрия и калия иодиды. Йод, раствор иода спиртовый 5%
Натрия и калия иодиды. Йод, раствор иода спиртовый 5% Витаминдер туралы жалпы түсінік. Майларда еритін витаминдер. Суда еритін витаминдер
Витаминдер туралы жалпы түсінік. Майларда еритін витаминдер. Суда еритін витаминдер Строение вещества
Строение вещества Презентация по Химии "Химия вокруг нас" - скачать смотреть
Презентация по Химии "Химия вокруг нас" - скачать смотреть  Оксид серы(IV). Сернистая кислота. Учитель химии МБОУ «Елховская СОШ» Альметьевского муниципального района Республики Татарстан Г
Оксид серы(IV). Сернистая кислота. Учитель химии МБОУ «Елховская СОШ» Альметьевского муниципального района Республики Татарстан Г Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Витамины. Общая характеристика. Классификация. Витамины алифатического строения. Витамин С
Витамины. Общая характеристика. Классификация. Витамины алифатического строения. Витамин С