Содержание
- 2. ОСНОВНЫЕ ФУНКЦИИ БЕЛКОВ структурная (эластин, коллаген); сократительная (актин, миозин); транспортная (гемоглобин, альбумин); гормональная (гормоны передней доли
- 3. НЕКОТОРЫЕ ОСОБЕННОСТИ ОБМЕНА БЕЛКОВ ежедневно в организме взрослого человека распадаются до аминокислот 200–400 г белков; период
- 4. в организме животных нет депо аминокислот и белков, они могут лишь перераспределяться между отдельными тканями; физиологический
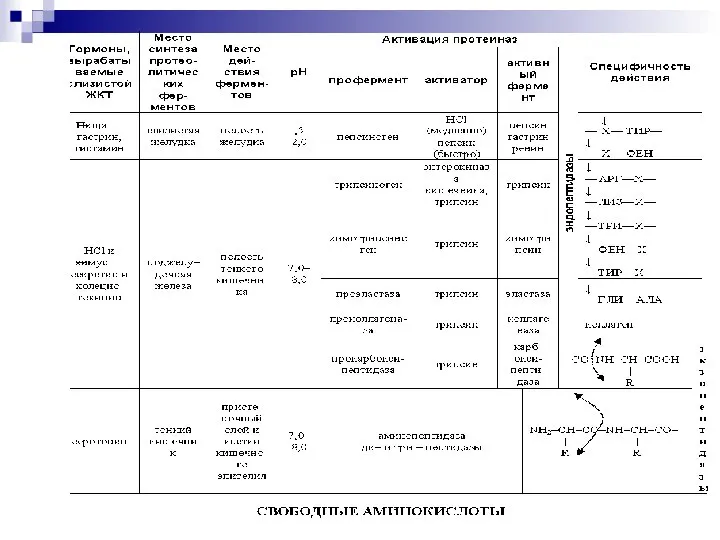
- 5. Переваривание белков в желудочно–кишечном тракте биологический смысл переваривания белков - потеря видовой специфичности; механизм переваривания -
- 6. РОЛЬ HCl активация пепсиногена; денатурация белков пищи; бактерицидное действие НСl; всасывание железа
- 8. гиперхлоргидрия – увеличение содержания свободной соляной кислоты и общей кислотности. Она чаще всего наблюдается при язвенной
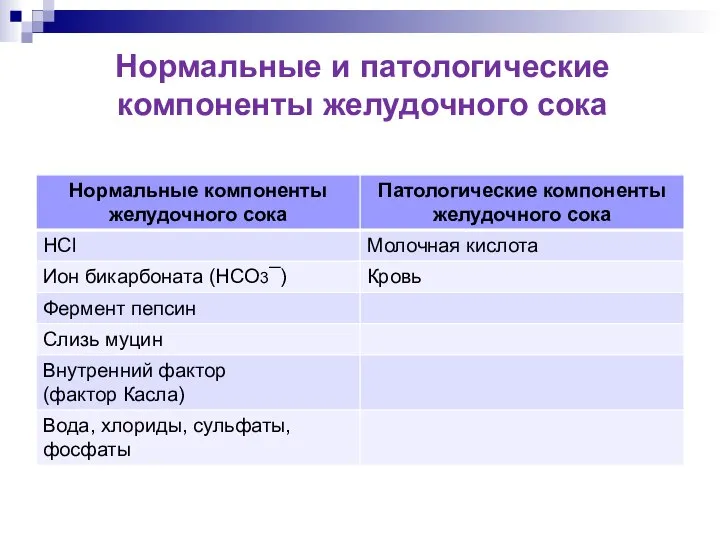
- 9. Нормальные и патологические компоненты желудочного сока
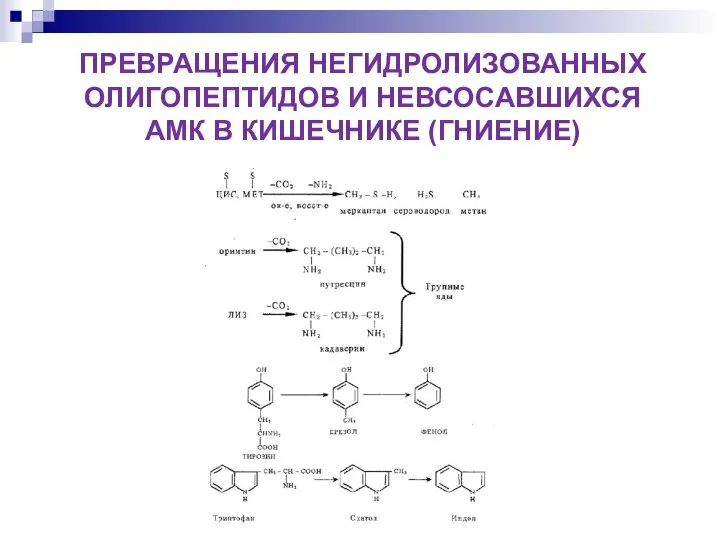
- 10. ПРЕВРАЩЕНИЯ НЕГИДРОЛИЗОВАННЫХ ОЛИГОПЕПТИДОВ И НЕВСОСАВШИХСЯ АМК В КИШЕЧНИКЕ (ГНИЕНИЕ)
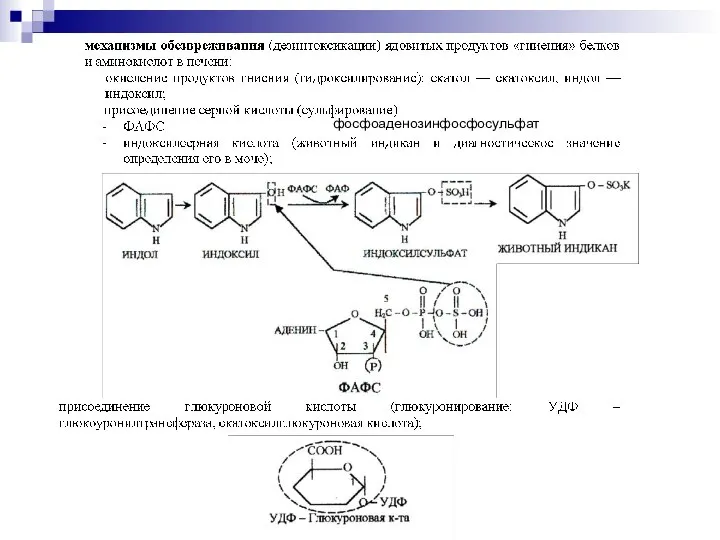
- 11. фосфоаденозинфосфосульфат фоми
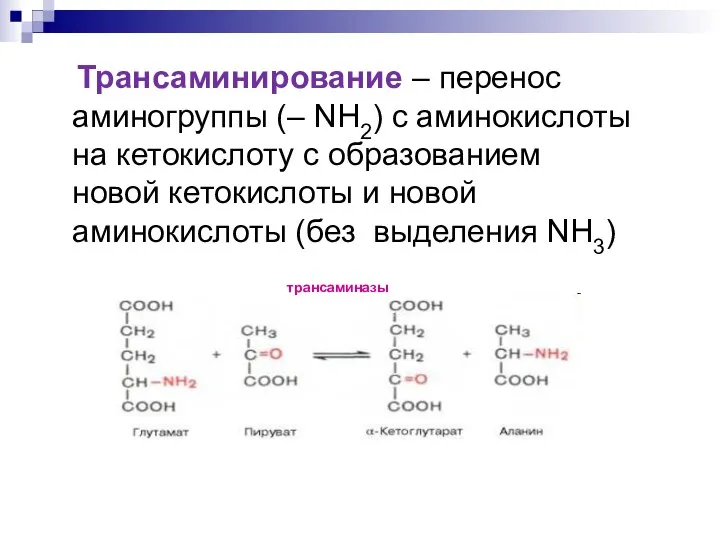
- 13. Трансаминирование – перенос аминогруппы (– NH2) с аминокислоты на кетокислоту с образованием новой кетокислоты и новой
- 14. Дезаминирование аминокислот – это отщепление аминогруппы (-NH2 ) от аминокислоты в виде аммиака (NH3) с образованием
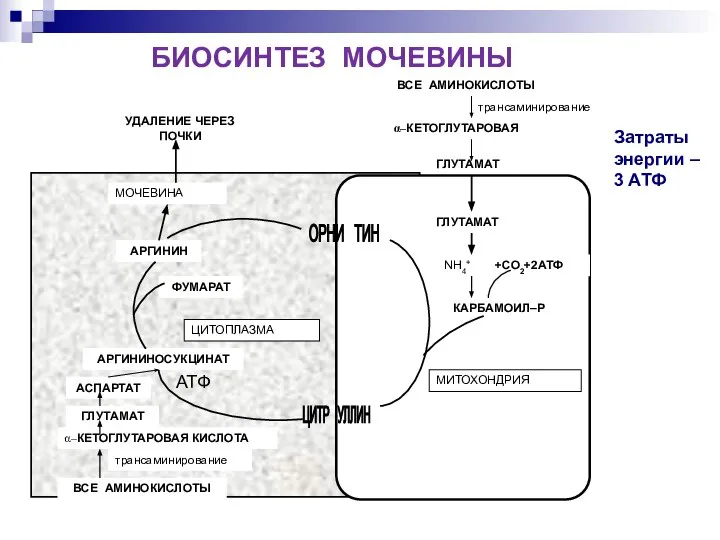
- 17. Затраты энергии – 3 АТФ БИОСИНТЕЗ МОЧЕВИНЫ АТФ
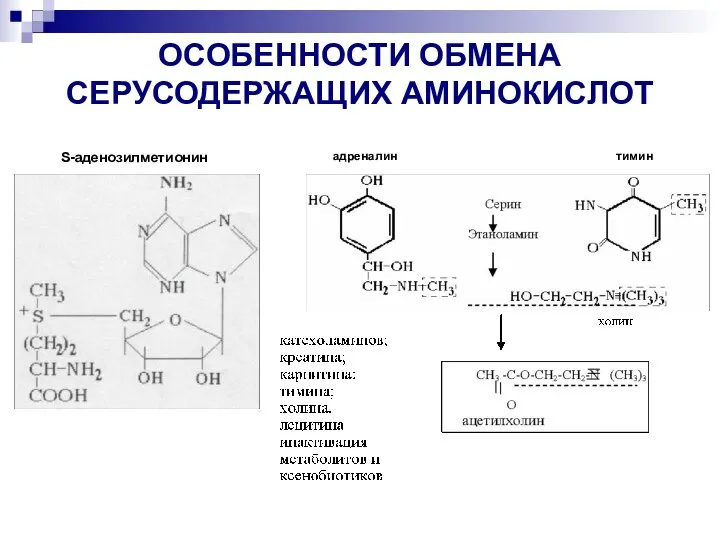
- 18. S-аденозилметионин ОСОБЕННОСТИ ОБМЕНА СЕРУСОДЕРЖАЩИХ АМИНОКИСЛОТ адреналин тимин
- 19. СИНТЕЗ КРЕАТИНА И КРЕАТИНФОСФАТА Мышцы, мозг
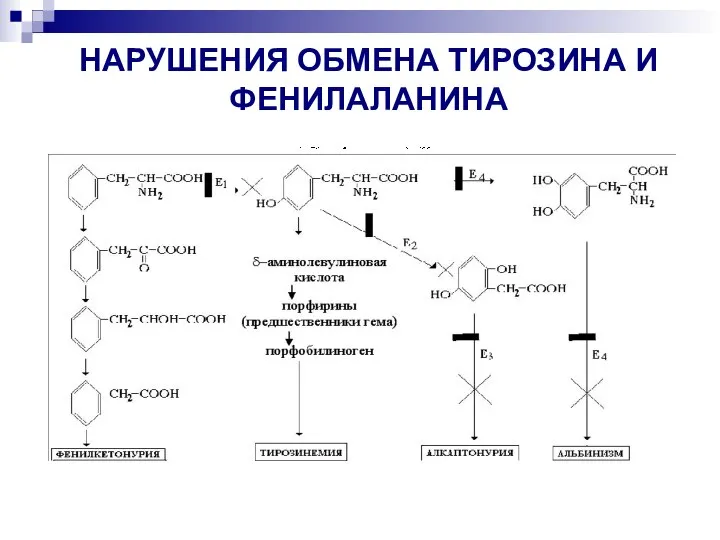
- 20. НАРУШЕНИЯ ОБМЕНА ТИРОЗИНА И ФЕНИЛАЛАНИНА
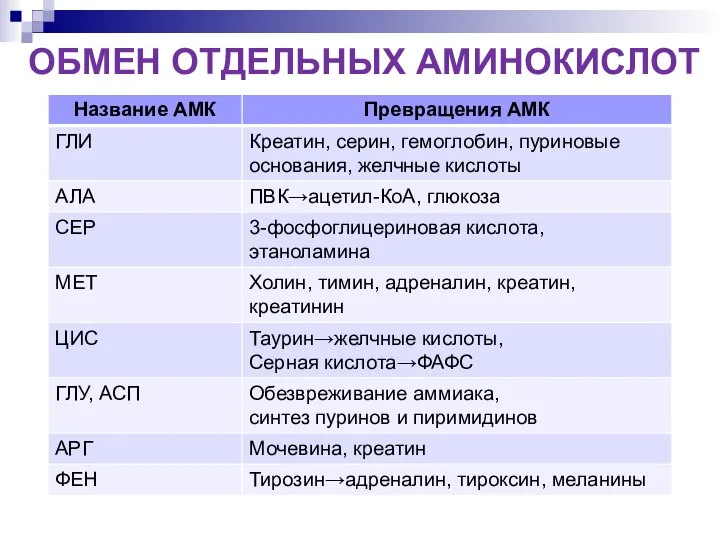
- 21. ОБМЕН ОТДЕЛЬНЫХ АМИНОКИСЛОТ
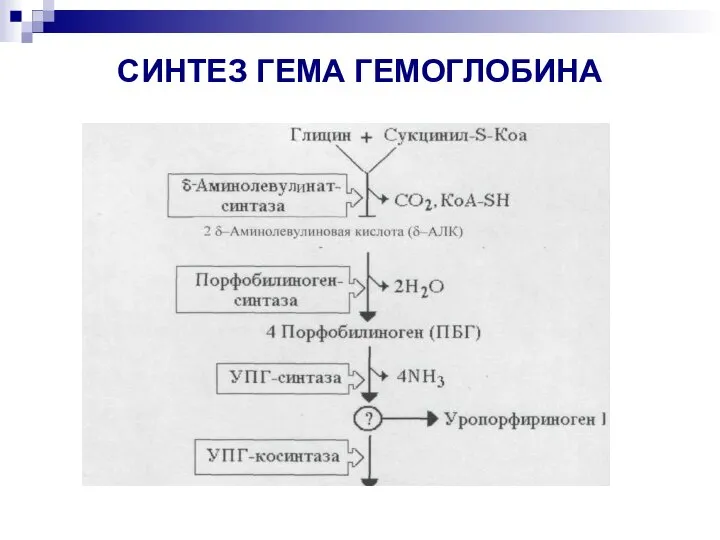
- 22. СИНТЕЗ ГЕМА ГЕМОГЛОБИНА
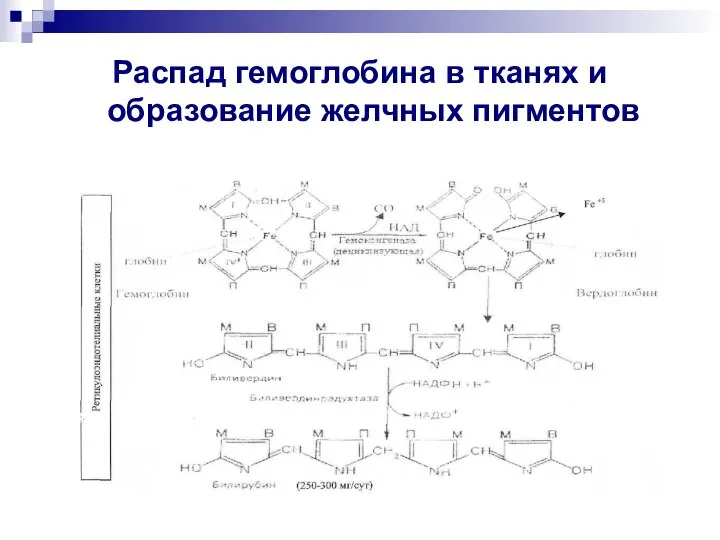
- 24. Распад гемоглобина в тканях и образование желчных пигментов
- 25. Комплекс альбумин - билирубин доставляется с током крови в печень Механизм обезвреживания билирубина - образование коньюгированного
- 26. Непрямой билирубин (неконьюгированный, свободный) Прямой билирубин (коньюгированный, связанный)
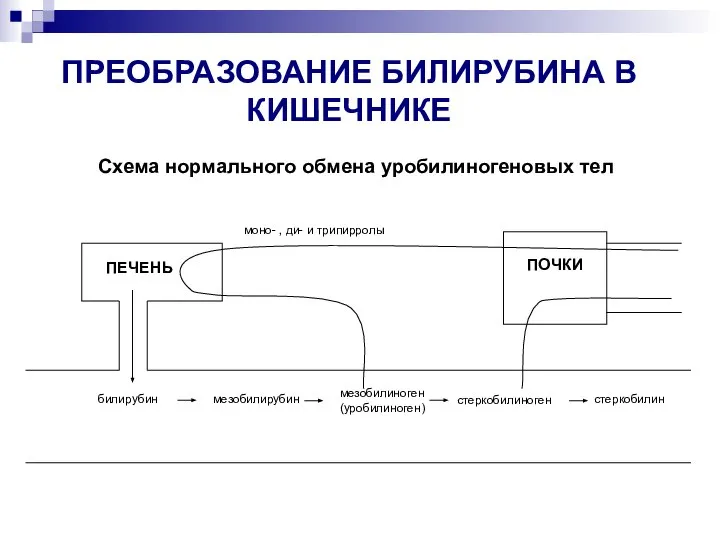
- 27. ПРЕОБРАЗОВАНИЕ БИЛИРУБИНА В КИШЕЧНИКЕ
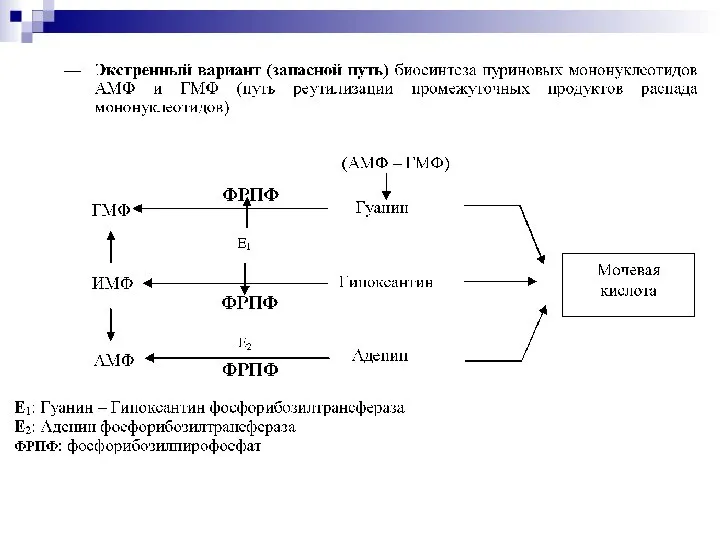
- 30. ОБМЕН НУКЛЕОПРОТЕИНОВ
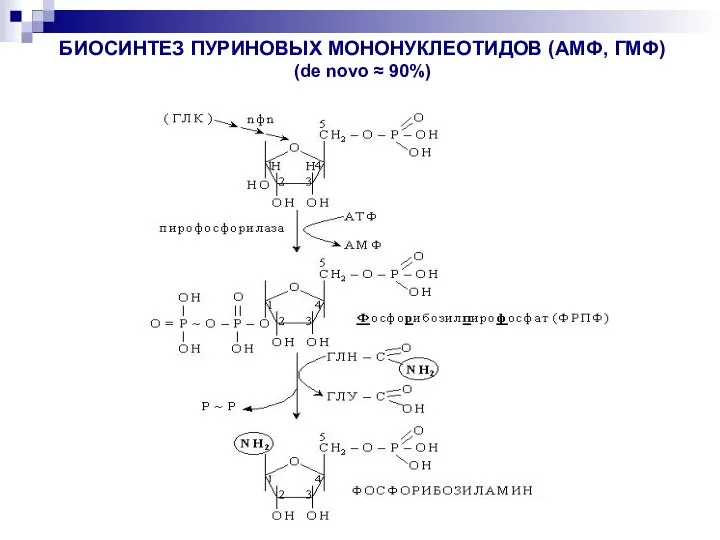
- 31. БИОСИНТЕЗ ПУРИНОВЫХ МОНОНУКЛЕОТИДОВ (АМФ, ГМФ) (de novo ≈ 90%)
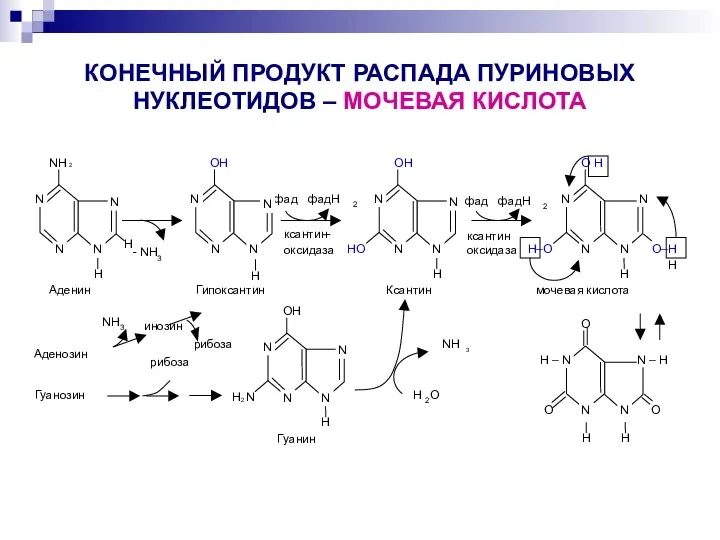
- 34. КОНЕЧНЫЙ ПРОДУКТ РАСПАДА ПУРИНОВЫХ НУКЛЕОТИДОВ – МОЧЕВАЯ КИСЛОТА
- 40. Скачать презентацию





















 Філософія державного контролю якості лікарських засобів. Міжнародний досвід управління якістю у фармацевтичній галузі
Філософія державного контролю якості лікарських засобів. Міжнародний досвід управління якістю у фармацевтичній галузі Азот
Азот Тепло- и массообменные процессы при синтезе Фишера-Тропша
Тепло- и массообменные процессы при синтезе Фишера-Тропша Химический элемент натрий
Химический элемент натрий Кислотно-основные взаимодействия
Кислотно-основные взаимодействия Номенклатура органических соединений. Структурные формулы соединений. Алканы. (Лабораторная работа 2)
Номенклатура органических соединений. Структурные формулы соединений. Алканы. (Лабораторная работа 2) Природный и попутный газ
Природный и попутный газ Презентация по химии Роль Химии в жизни общества
Презентация по химии Роль Химии в жизни общества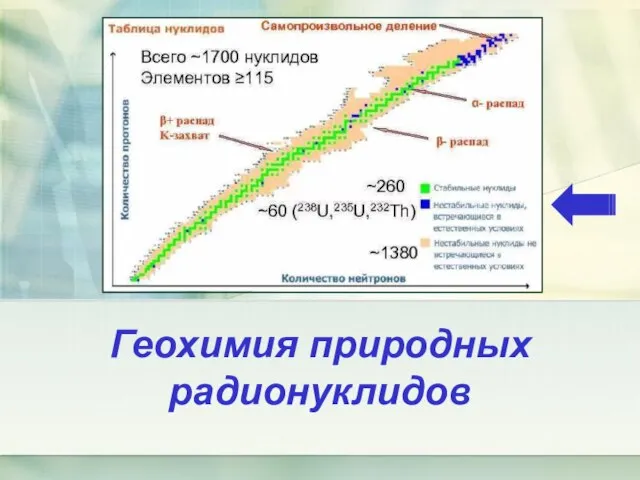 Геохимия природных радионуклидов (тема 1)
Геохимия природных радионуклидов (тема 1) Оксиды и гидроксиды металлов
Оксиды и гидроксиды металлов Значение основных химических элементов в жизни человека
Значение основных химических элементов в жизни человека № 12.
№ 12.  Автор: учитель МОУ «вечерняя школа №1» Автозаводского района г.Н.Новгорода Л.Л.Удовыдченкова
Автор: учитель МОУ «вечерняя школа №1» Автозаводского района г.Н.Новгорода Л.Л.Удовыдченкова Алотропні видозміни Карбона та їх застосування Розмаїтого Дмитра
Алотропні видозміни Карбона та їх застосування Розмаїтого Дмитра  Кислород. 8 класс
Кислород. 8 класс Составления электронных и электронно-графических схем строения атома Разработал: учитель химии высшей категории Лебедев Сергей
Составления электронных и электронно-графических схем строения атома Разработал: учитель химии высшей категории Лебедев Сергей  Технология переработки полимеров
Технология переработки полимеров ГИА. Вопрос А2. ПЗ и ПСХЭ
ГИА. Вопрос А2. ПЗ и ПСХЭ Применение центрифугирования
Применение центрифугирования Фізичні й хімічні явища у природі
Фізичні й хімічні явища у природі Российские химические технологии
Российские химические технологии Бумага - важнейший элемент человеческой культуры, основа просвещения и воспитания человека.
Бумага - важнейший элемент человеческой культуры, основа просвещения и воспитания человека.  Побутові хімікати Підготував
Побутові хімікати Підготував  Масс-спектры спиртов и фенолов
Масс-спектры спиртов и фенолов Тағамдық қоспалардың гигиеналық регламенттелуі
Тағамдық қоспалардың гигиеналық регламенттелуі Виды присадок к моторным топливам. Керосин
Виды присадок к моторным топливам. Керосин Основания. Состав, названия и определение оснований (8 класс)
Основания. Состав, названия и определение оснований (8 класс) Коррозия металлов
Коррозия металлов