Содержание
- 2. Система комплексообразователь–лиганды называется внутренней координационной сферой, обычно отделяемой квадратными скобками от внешней координационной сферы: K4[Fe(CN)6], [Cr(NH3)6]Cl3,
- 3. Комплексообразователь Образование комплексного иона или нейтрального комплекса можно представить себе в виде обратимой реакции общего типа:
- 4. Константы равновесия Ступенчатые и общие константы образования (устойчивости) и нестойкости комплексных ионов соотносятся друг с другом
- 5. Hg2+ + Cl− = [HgCl]+; K1 = 1,85 . 105 [HgCl]+ + Cl− = [HgCl2]; K2
- 6. Как правило, ступенчатые константы устойчивости уменьшаются по мере возрастания числа лигандов. Основные причины: -возрастание пространственных затруднений
- 8. Основные методы, описывающие химическую связь в комплексных соединениях: -МВС -ТКП -ММО
- 9. Метод валентных связей Положения метода МВС: 1) Связь между КО и лигандами образуется по донорно-акцепторному механизму,
- 10. Геометрическое строение и тип гибридизации комплексных ионов:
- 11. 3) Заполнение электронными парами лигандов орбиталей комплексообразователя возможно по 2м вариантам: а) Заполнение пустых орбиталей комплексообразователя
- 12. Вариант выбирается по сравнению двух энергий: Е связи - выигрыш энергии за счет образования связи Е
- 13. Спектрохимический ряд лигандов I– лиганды слабого поля (работает правило Хунда) NH3 лиганды сильного поля (правило Хунда
- 14. Например, [Co(NH3)4CO3]NO3
- 15. 4) Магнитные свойства комплексных ионов: а) отсутствие неспаренных электронов характеризует диамагнитные свойства комплексного иона б) наличие
- 16. [NiBr4]2− Niº [Ar]3d84s24p0 Ni2+ [Ar]3d84s0 4p0 Br– - лиганд слабого поля
- 17. [Ni(CN)4]2− CN– - лиганд сильного поля
- 18. [Ni(CN)5] 3– образуется в условиях избытка лиганда. Устойчивый диамагнитный комплекс имеет форму квадратной пирамиды.
- 19. [Niº(CO)4]
- 20. Дативная связь: а) донорно – акцепторная связь, где донор – комплексообразователь акцептор – лиганд (разрыхляющие МО
- 21. МВС не дает ответа на вопрос, какой вид комплекса образуется в каждом конкретном случае, так как
- 22. Теория кристаллического поля (ТКП) ТКП пришла на смену теории валентных связей в 40-х годах XX столетия.
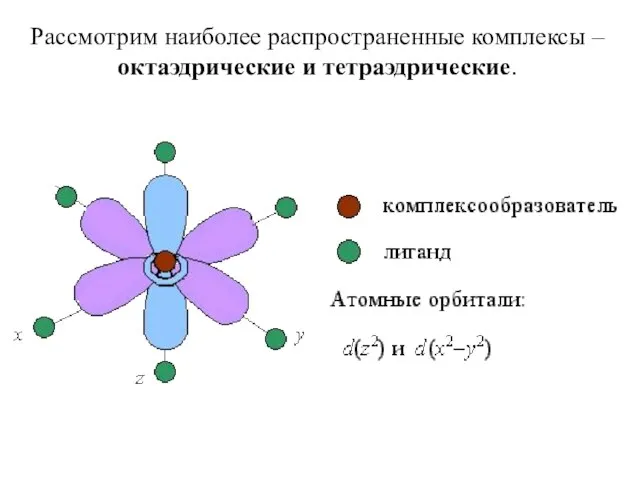
- 23. Рассмотрим наиболее распространенные комплексы – октаэдрические и тетраэдрические.
- 25. В центре октаэдра находится атом-КО с электронами на d-атомных орбиталях, а в его вершинах – L
- 26. Таким образом, пятикратно вырожденные d-АО КО, попадая в октаэдрическое поле лигандов, подвергаются расщеплению на две группы
- 28. Разность энергий двух новых подуровней dε и dγ получила название параметра расщепления Δ0, показывающего выигрыш энергии:
- 29. Для сохранения общей энергии должно выполняться равенство: 4(Е2 – Е0) = 6(Е0 – Е1), где 4
- 30. Энергия стабилизации кристаллическим полем ЭСКП – выигрыш энергии за счет заполнения низких по энергии d-уровней относительно
- 31. Изучение параметра расщепления, как правило, основано на спектроскопических исследованиях. Параметр расщепления зависит от: типа лиганда Чем
- 32. 2) степени окисления и природы КО. В комплексах, включающих КО одного и того же периода и
- 33. 3) заряда ядра атома – КО При увеличении заряда ядра КО Δ0 тоже растет. [Co(NH3)6]3+,- 22900
- 34. При этом независимо от значения параметра расщепления первые три электрона занимают квантовые ячейки dε-подуровня:
- 37. При восьмиэлектронной конфигурации и далее различия в строении между комплексами с L слабого и сильного поля
- 38. Рассмотрим электронное строение октаэдрических комплексных ионов [Co(NH3)6]3+ и [CoF6]3− : Co0 [Ar]3d74s2 Co3+ [Ar]3d64s0 F− –
- 40. Цветность комплексных соединений Многие КС в кристаллическом состоянии и водном растворе отличаются яркой окраской. ТКП позволяет
- 41. Если через раствор (кристалл) вещества пропускать свет видимой части спектра (410 -720 нм), то возможны три
- 42. Таким образом, цвет раствора или кристаллов определяется частотой полос поглощения видимого света:
- 43. Длины волн полос поглощения комплексов λ в кристаллическом состоянии или в растворе, обусловленные переходом электронов с
- 44. Например, при пропускании света через водный раствор, содержащий ионы [Ti(H2O)6]3+, обнаруживается полоса поглощения света в желто-зеленой
- 45. Если комплексообразователь имеет электронную конфигурацию d0 или d10, то переходы электронов с dε- на dγ-подуровень или
- 46. В отличие от МВС, ТКП, основываясь на электронной конфигурации центрального атома, положении лигандов в спектрохимическом ряду
- 47. Уже с середины 50-х годов упрощенная ТКП поля была заменена усовершенствованной теорией поля лигандов, учитывающей ковалентный
- 48. Для комплекса волновая функция молекулярной орбитали ψмо представляет собой линейную комбинацию, состоящую из волновых функций орбитали
- 49. Схемы МО октаэдрических комплексов: высокоспинового [FeF6]4– (a) и низкоспинового [Fe(CN)6]4– (б).
- 50. Шесть σ-орбиталей L объединяются в 6 групповых орбиталей, каждая из которых может перекрываться только с одной
- 51. В отличие от ТКП здесь более обоснована стабильность комплексного иона, определяющаяся, главным образом, энергией образования 6
- 53. Скачать презентацию



![Hg2+ + Cl− = [HgCl]+; K1 = 1,85 . 105 [HgCl]+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/530063/slide-4.jpg)








![Например, [Co(NH3)4CO3]NO3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/530063/slide-13.jpg)

![[NiBr4]2− Niº [Ar]3d84s24p0 Ni2+ [Ar]3d84s0 4p0 Br– - лиганд слабого поля](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/530063/slide-15.jpg)
![[Ni(CN)4]2− CN– - лиганд сильного поля](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/530063/slide-16.jpg)
![[Ni(CN)5] 3– образуется в условиях избытка лиганда. Устойчивый диамагнитный комплекс имеет форму квадратной пирамиды.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/530063/slide-17.jpg)
![[Niº(CO)4]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/530063/slide-18.jpg)

















![Рассмотрим электронное строение октаэдрических комплексных ионов [Co(NH3)6]3+ и [CoF6]3− : Co0](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/530063/slide-37.jpg)





![Например, при пропускании света через водный раствор, содержащий ионы [Ti(H2O)6]3+, обнаруживается](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/530063/slide-43.jpg)




![Схемы МО октаэдрических комплексов: высокоспинового [FeF6]4– (a) и низкоспинового [Fe(CN)6]4– (б).](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/530063/slide-48.jpg)


 Эта удивительная вода Эта удивительная вода
Эта удивительная вода Эта удивительная вода Кислород. 8 класс
Кислород. 8 класс Кислородсодержащие органические вещества. Фенолы
Кислородсодержащие органические вещества. Фенолы Бораты и силикаты как матрицы лазеров. Свойства и методы выращивания
Бораты и силикаты как матрицы лазеров. Свойства и методы выращивания Отбор проб товаров для анализа. Химико-аналитический контроль
Отбор проб товаров для анализа. Химико-аналитический контроль Методы химического анализа. Классификации методов анализа
Методы химического анализа. Классификации методов анализа Природные и попутные нефтяные газы
Природные и попутные нефтяные газы Явление аллотропии
Явление аллотропии Теория растворов. Диффузия в растворах. Коллигативные свойства растворов
Теория растворов. Диффузия в растворах. Коллигативные свойства растворов Обмен простых белков. Пути обмена аминокислот. (Тема 5)
Обмен простых белков. Пути обмена аминокислот. (Тема 5) Сера. Положение серы в периодической системе химических элементов Д.И. Менделеева
Сера. Положение серы в периодической системе химических элементов Д.И. Менделеева Подготовка к контрольной работе по химии
Подготовка к контрольной работе по химии Виды контроля коррозии
Виды контроля коррозии Біологічна хімія з основами фізичної і колоїдної хімії
Біологічна хімія з основами фізичної і колоїдної хімії Презентация по Химии "Углеводы" - скачать смотреть
Презентация по Химии "Углеводы" - скачать смотреть  Лабораторное оборудование, посуда и средства защиты Разработка для проведения практических работ по химии подготовила Нерев
Лабораторное оборудование, посуда и средства защиты Разработка для проведения практических работ по химии подготовила Нерев Состав воздуха и его загрязненность Отдел образования администрации Тальменского района Алтайского края
Состав воздуха и его загрязненность Отдел образования администрации Тальменского района Алтайского края Углеводороды. Алкены
Углеводороды. Алкены Жиры – биологически важные органические соединения Работа ученицы 11а класса МБОУ СОШ № 26 Ногинского района Московской облас
Жиры – биологически важные органические соединения Работа ученицы 11а класса МБОУ СОШ № 26 Ногинского района Московской облас Стратегия успеха 2 (ЕГЭ). Органическая химия
Стратегия успеха 2 (ЕГЭ). Органическая химия Чистые вещества и смеси. Способы разделения смесей
Чистые вещества и смеси. Способы разделения смесей Фосфор и его соединения
Фосфор и его соединения Виды топлива и их характеристика
Виды топлива и их характеристика Технология получения гидропероксида изопропилбензола
Технология получения гидропероксида изопропилбензола Неомыляемые липиды. Стероиды
Неомыляемые липиды. Стероиды Адсорбция. Поглощение газов или паров из газовых смесей или растворов твердым веществом
Адсорбция. Поглощение газов или паров из газовых смесей или растворов твердым веществом Презентация Простые вещества химия 8 класс
Презентация Простые вещества химия 8 класс Химия вокруг нас
Химия вокруг нас