Содержание
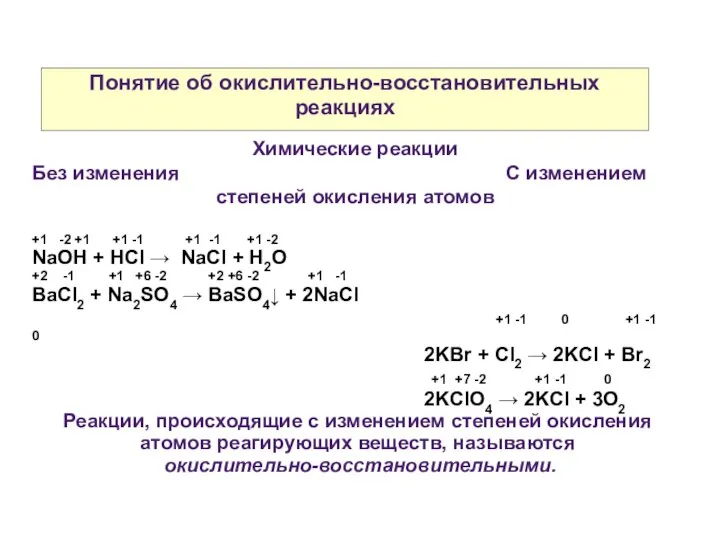
- 2. Понятие об окислительно-восстановительных реакциях Химические реакции Без изменения С изменением степеней окисления атомов +1 -2 +1
- 3. Понятие об окислительно-восстановительных реакциях Степень окисления — это условный заряд атома, вычисленный из предположения о том,
- 4. Понятие об окислительно-восстановительных реакциях Окисление — процесс отдачи электронов. Отдает восстановитель — восстанавливает, окисляется. -1 0
- 5. Понятие об окислительно-восстановительных реакциях Правила определения степеней окисления в соединениях: 1. Степени окисления атомов в простых
- 6. Классификация окислительно-восстановительных реакций Различают следующие типы окислительно- восстановительных реакций: - межмолекулярные - внутримолекулярные - конпропорционирования -
- 7. Классификация окислительно-восстановительных реакций В межмолекулярных и окислитель, и восстановитель находятся в разных веществах: 0 0 +3
- 8. Классификация окислительно-восстановительных реакций Во внутримолекулярных и окислитель, и восстановитель находятся в одном веществе, но в разных
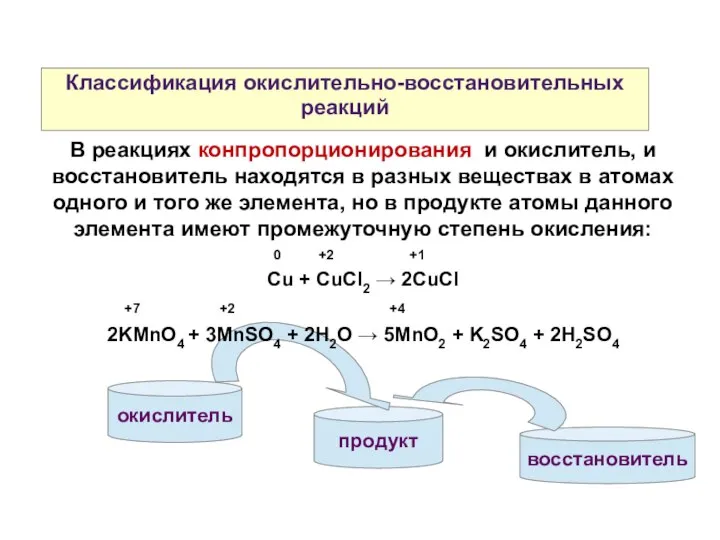
- 9. продукт Классификация окислительно-восстановительных реакций В реакциях конпропорционирования и окислитель, и восстановитель находятся в разных веществах в
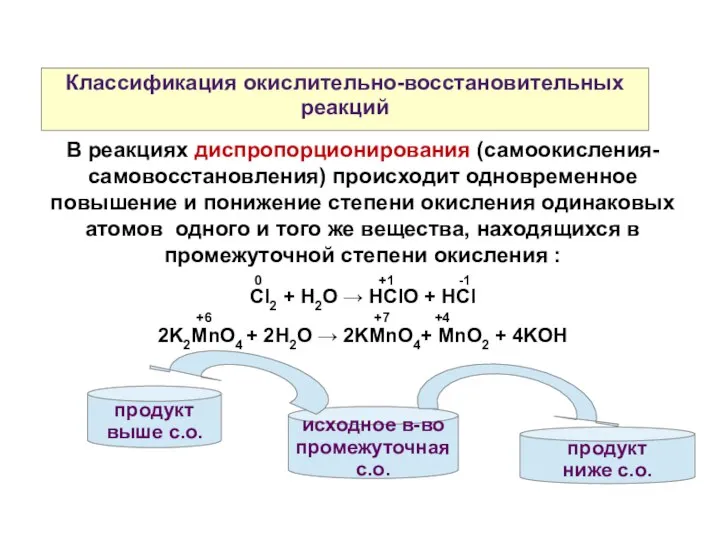
- 10. продукт выше с.о. Классификация окислительно-восстановительных реакций В реакциях диспропорционирования (самоокисления-самовосстановления) происходит одновременное повышение и понижение степени
- 11. Окислители и восстановители. Окислительно-восстановительная двойственность. Окислители — вещества, содержащие атомы в высшей степени окисления: КMnO4, K2Cr2O7,
- 12. Окислители и восстановители. Окислительно-восстановительная двойственность. Восстановители — вещества, содержащие атомы в низшей степени окисления: NH3, сульфиды,
- 13. Окислители и восстановители. Окислительно-восстановительная двойственность. Вещества, содержащие атомы в промежуточных степенях окисления, проявляют окислительно-восстановительную двойственность: H2O2,
- 14. Методы составления окислительно-восстановительных реакций Метод электронного баланса: применяют для реакций, протекающих между молекулами и и не
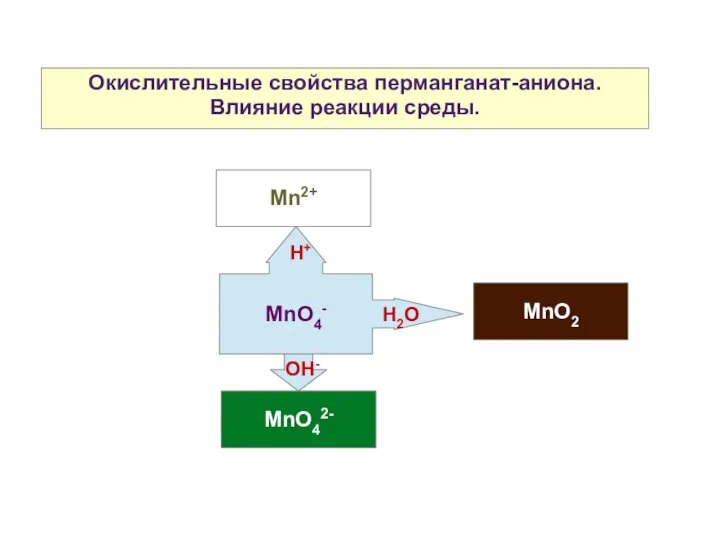
- 15. Окислительные свойства перманганат-аниона. Влияние реакции среды. Mn2+ MnO2 MnO42- MnO4- H+ H2O OH-
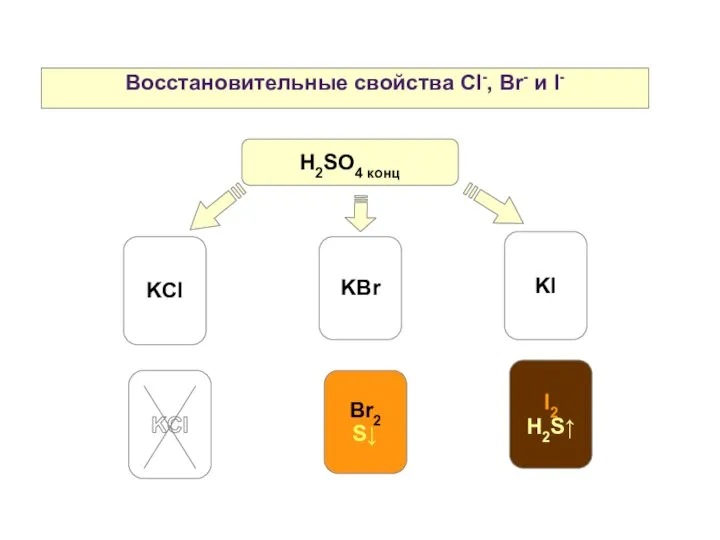
- 16. Восстановительные свойства Cl-, Br- и I- KCl KBr KI H2SO4 конц Br2 S↓ I2 H2S↑
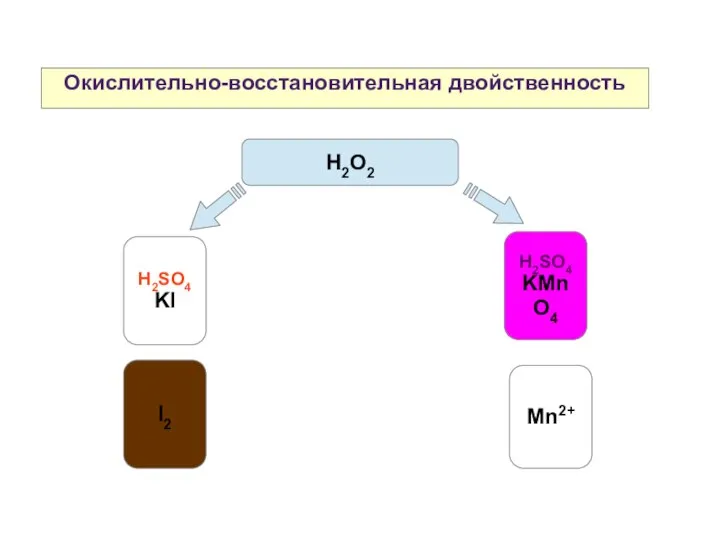
- 17. Окислительно-восстановительная двойственность H2SO4 KI H2SO4 KMnO4 H2О2 Mn2+ I2
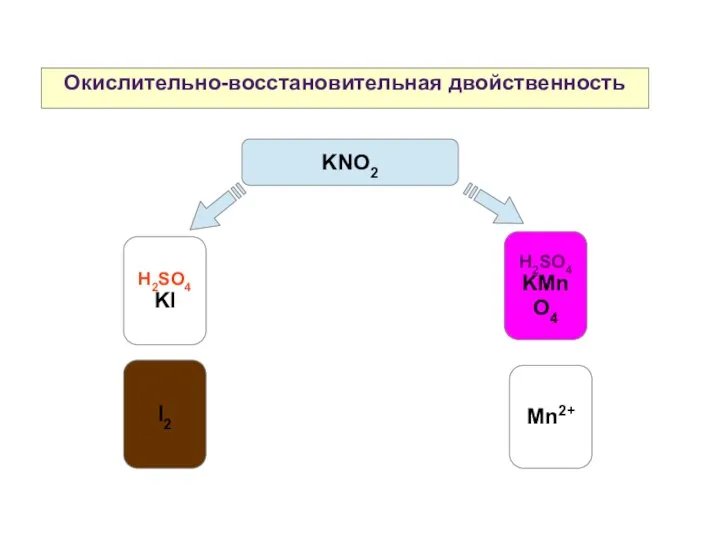
- 18. Окислительно-восстановительная двойственность H2SO4 KI H2SO4 KMnO4 KNO2 Mn2+ I2
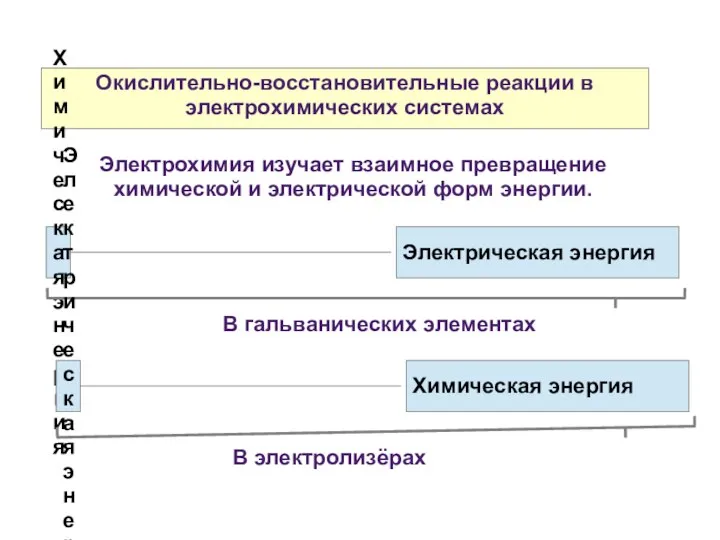
- 19. Окислительно-восстановительные реакции в электрохимических системах
- 20. Окислительно-восстановительные реакции в электрохимических системах Каждая окислительно-восстановительная (redox от reduction-oxidation — восстановление-окисление) реакция объединяет в себе
- 21. Окислительно-восстановительные реакции в электрохимических системах Если процессы окисления и восстановления пространственно разделить, то окислительно-восстановительную реакцию можно
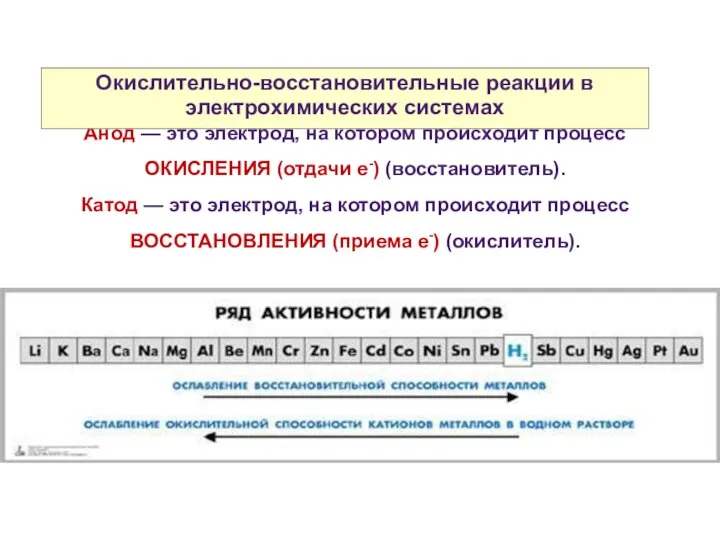
- 22. Принцип работы гальванического элемента Анод — это электрод, на котором происходит процесс ОКИСЛЕНИЯ (отдачи е-) (восстановитель).
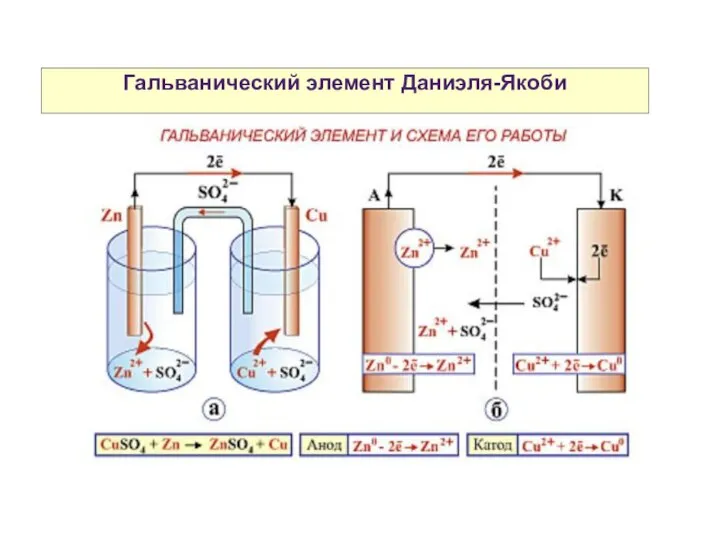
- 23. Гальванический элемент Даниэля-Якоби
- 24. Гальванический элемент Даниэля-Якоби Схема гальванического элемента Даниэля-Якоби: (-) Zn|Zn2+||Cu2+|Cu (+)
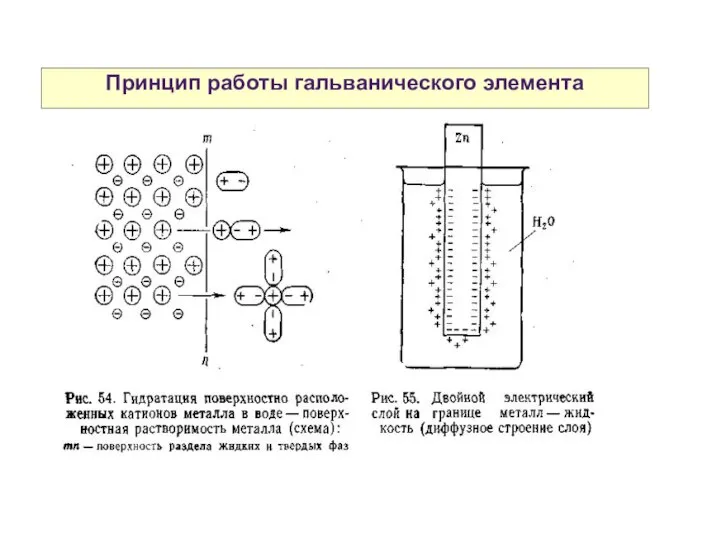
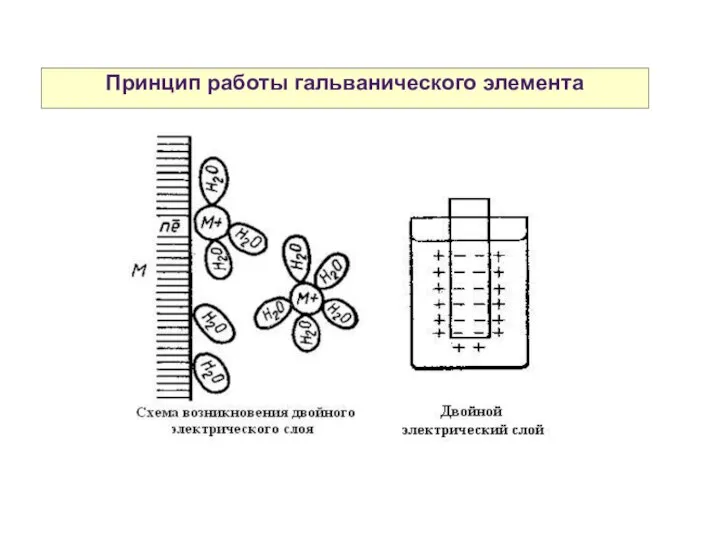
- 25. Принцип работы гальванического элемента
- 26. Принцип работы гальванического элемента
- 27. Принцип работы гальванического элемента ΔНрешетки > 0 ΔНгидратации В зависимости от величины значений данных энтальпий на
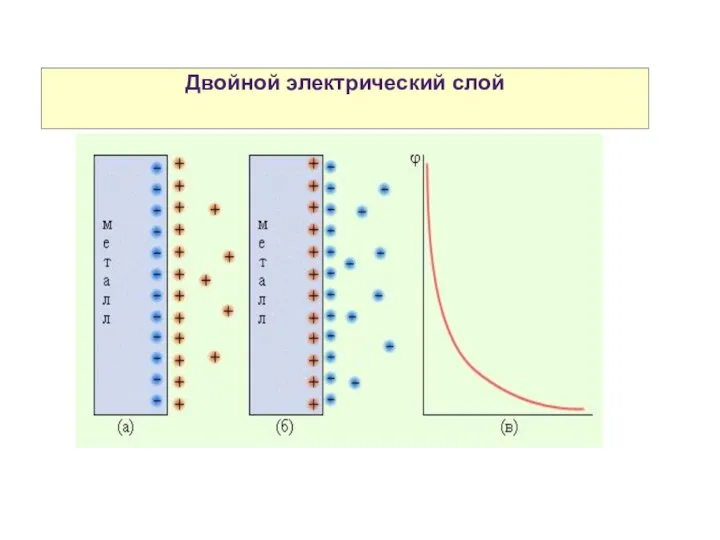
- 28. Двойной электрический слой
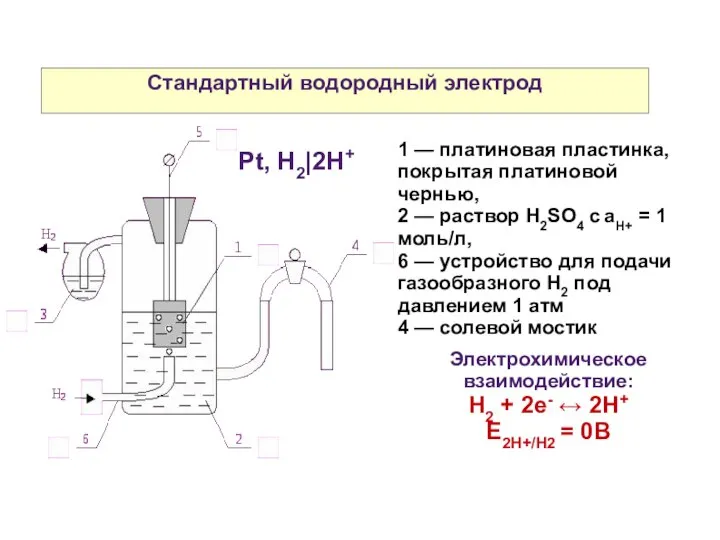
- 29. Стандартный водородный электрод 1 — платиновая пластинка, покрытая платиновой чернью, 2 — раствор H2SO4 c aH+
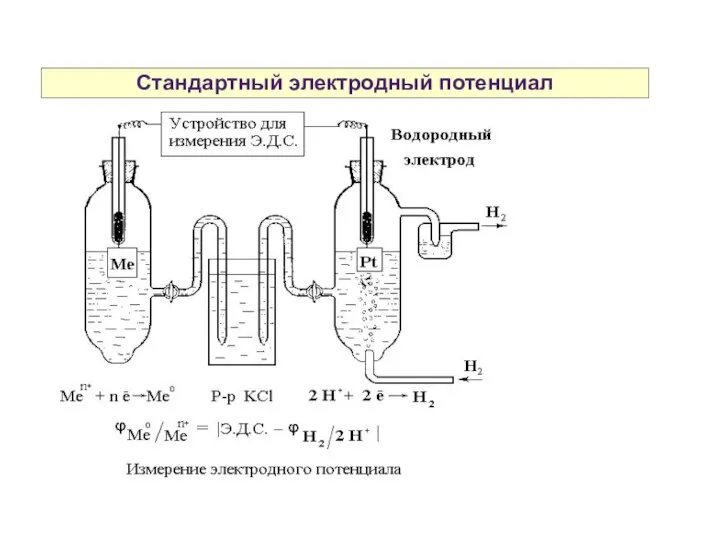
- 30. Стандартный электродный потенциал
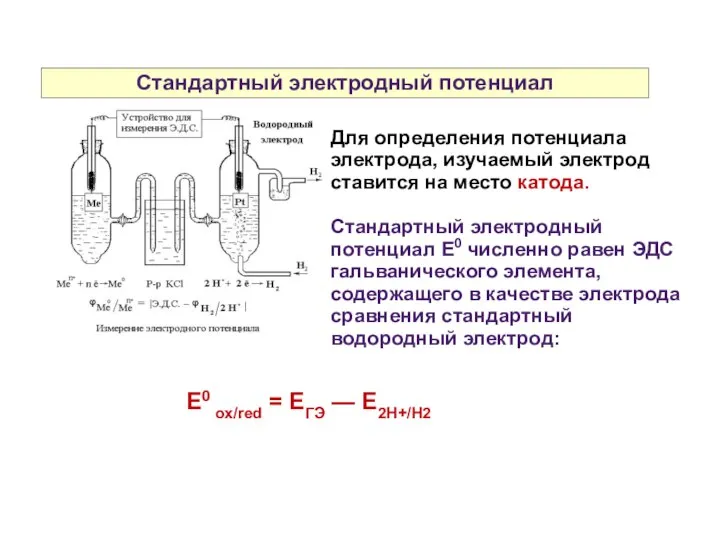
- 31. Стандартный электродный потенциал Для определения потенциала электрода, изучаемый электрод ставится на место катода. Стандартный электродный потенциал
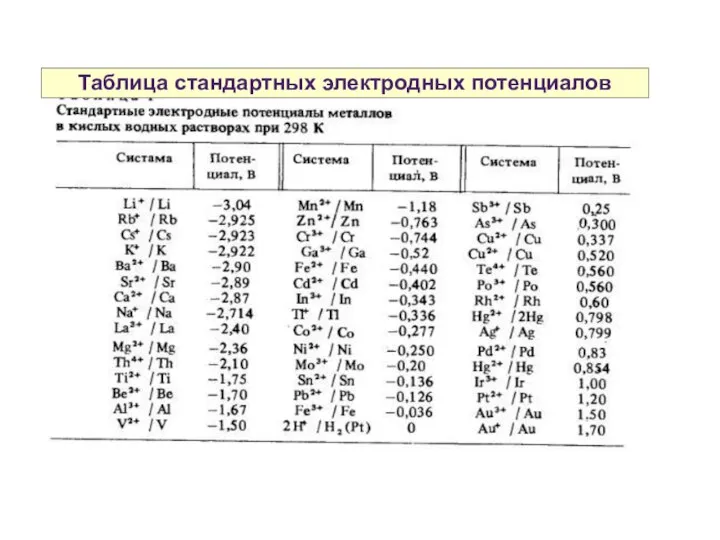
- 32. Таблица стандартных электродных потенциалов
- 33. Стандартный электродный потенциал При составлении ГЭ, электрод с более положительным потенциалом будет выполнять функции катода (окислителя),
- 35. Скачать презентацию















 Презентация Маргариты Шуминой
Презентация Маргариты Шуминой Полимеры. Каучуки. Резина
Полимеры. Каучуки. Резина Твердые тела и их физические свойства
Твердые тела и их физические свойства Общие свойства живых организмов
Общие свойства живых организмов Едкость Coca-Cola
Едкость Coca-Cola Кристаллизация. Структура жидких металлов
Кристаллизация. Структура жидких металлов Химические элементы и организм человека
Химические элементы и организм человека Получение нанокапель методом сверхзвукового разшерения
Получение нанокапель методом сверхзвукового разшерения СЕРА СЕРА 9 класс
СЕРА СЕРА 9 класс Презентація по хімії на тему:БУДІВЕЛЬНІ МАТЕРІАЛИ
Презентація по хімії на тему:БУДІВЕЛЬНІ МАТЕРІАЛИ  Алкалоидтар. Алкалоидтар туралы жалпы түсінік
Алкалоидтар. Алкалоидтар туралы жалпы түсінік Окислительно-восстановительный процесс - электролиз
Окислительно-восстановительный процесс - электролиз Склад нафти Підготувала: Учениця 11 – Б, Костенко Еліна
Склад нафти Підготувала: Учениця 11 – Б, Костенко Еліна 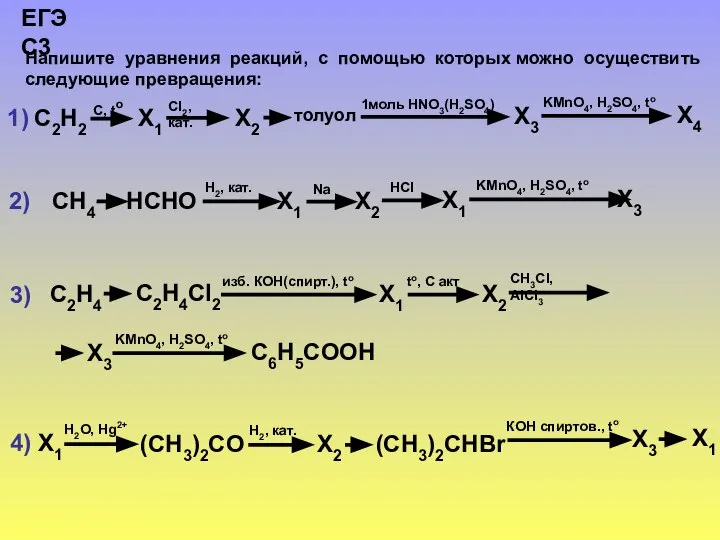 ЕГЭ по химии. Задание С3
ЕГЭ по химии. Задание С3 Металдар арасындағы беттік керіліс
Металдар арасындағы беттік керіліс Химико-биологический профиль
Химико-биологический профиль Массовая доля
Массовая доля Основные свойства материалов
Основные свойства материалов Химия в судостроении
Химия в судостроении Коллоидная химия
Коллоидная химия Азот и его соединения
Азот и его соединения Зелёная химия
Зелёная химия Решение расчетных задач на вывод молекулярной формулы вещества по массовым долям элементов
Решение расчетных задач на вывод молекулярной формулы вещества по массовым долям элементов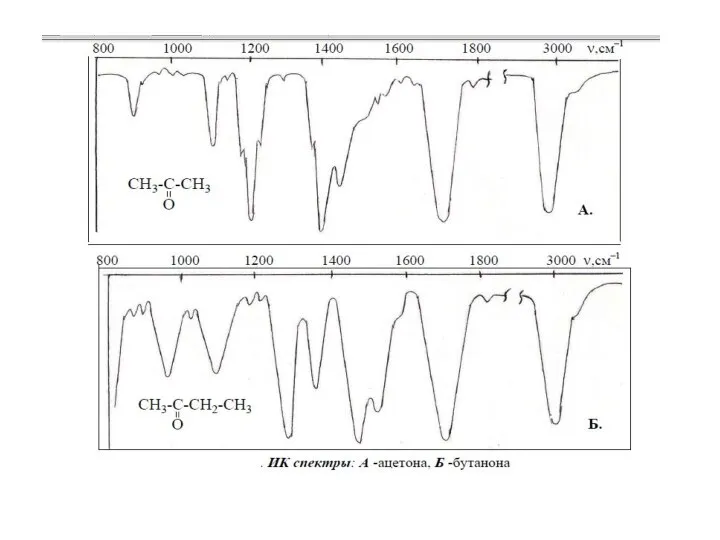 ИК-спектры органических соединений
ИК-спектры органических соединений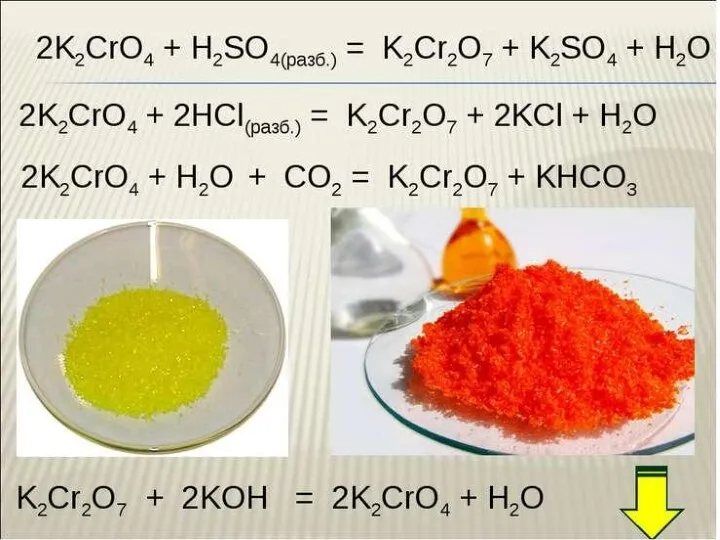 Хром. Соединения хрома
Хром. Соединения хрома Презентация по Химии "Соединения серы (11 класс)" - скачать смотреть
Презентация по Химии "Соединения серы (11 класс)" - скачать смотреть  Полиэтилен — [—CH2--CH2—]n ақ түсті термопластикалық полимер
Полиэтилен — [—CH2--CH2—]n ақ түсті термопластикалық полимер Характеристика металу Sr
Характеристика металу Sr