Содержание
- 2. С О Е Д И Н Е Н И Я С Е Р Ы
- 3. степень окисления серы -2 Сероводород - Н2S Сульфиды неметаллов – CS2, P2S3 Сульфиды металлов – Al2S3,
- 4. Н2S СЕРОВОДОРОД Это - ядовитый газ со специфическим запахом, тяжелее воздуха и кислорода, растворимый в воде.
- 5. Получение: водород + сера H2 + S ----H2S сульфид металла + сильная кислота ZnS + 2HCL---ZnCl2
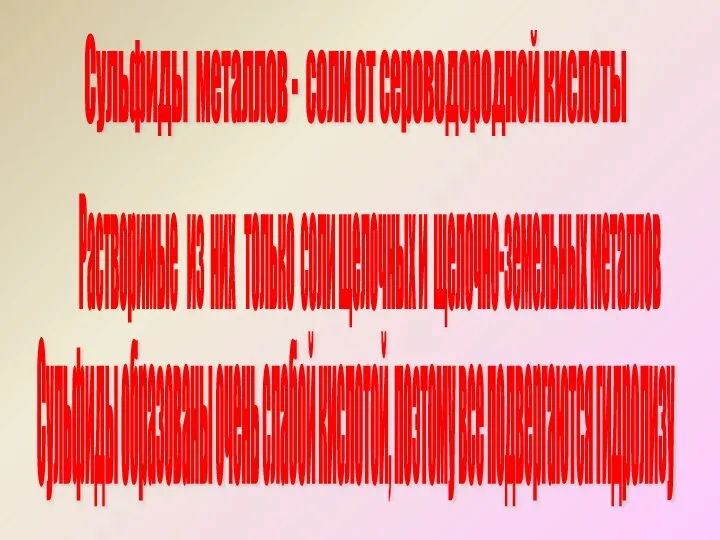
- 6. Сульфиды металлов - соли от сероводородной кислоты Сульфиды образованы очень слабой кислотой, поэтому все подвергаются гидролизу
- 7. степень окисления серы + 4 Сернистый газ –SO2 Сернистая кислота –H2SO3 Сульфиты – K2SO3, BaSO3
- 8. СЕРНИСТЫЙ ГАЗ SO2 Оксид серы(lV) – сернистый газ, являющийся одним из главных загрязнителей атмосферного воздуха, кислотный
- 9. Получение: разложение сернистой кислоты H2SO3 -----SO2 + H2O сгорание серы S + O2 ---SO2 обжиг сульфидов
- 10. Химические свойства: с водой SO2 + H2O---H2SO3 с основными оксидами SO2 + BaO---BaSO3 с щелочами SO2
- 11. Составьте уравнения реакций оксида серы (Vl) с водой, оксидом натрия, гидроксидом кальция, оксидом алюминия. Назовите продукты
- 12. Сернистая кислота – очень слабая, неустойчивая, легко разлагается на сернистый газ и воду (является аналогом угольной
- 13. степень окисления серы + 6 Серный ангидрид или оксид серы (Vl) –SO3 Серная кислота –H2SO4 Сульфаты
- 14. Оксид серы (Vl) – кислотный оксид, получается при окислении сернистого газа 2SO2 + O2---2SO3 Химические свойства
- 15. Н2SO4 Два вида солей от серной кислоты: средние – сульфаты CaSO4 и кислые – гидросульфаты Ba(HSO4)2
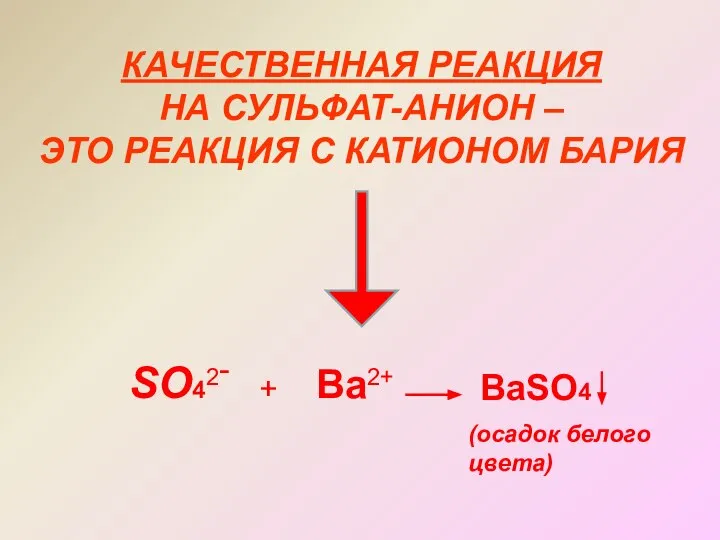
- 16. КАЧЕСТВЕННАЯ РЕАКЦИЯ НА СУЛЬФАТ-АНИОН – ЭТО РЕАКЦИЯ С КАТИОНОМ БАРИЯ SO42- + Ba2+ BaSO4 (осадок белого
- 17. Н2SO4 Серная кислота - тяжелая бесцветная жидкость, которая бывает концентрированная и разбавленная, в зависимости от этого
- 18. Взаимодействие разбавленной и концентрированной кислоты с металлами разной активности
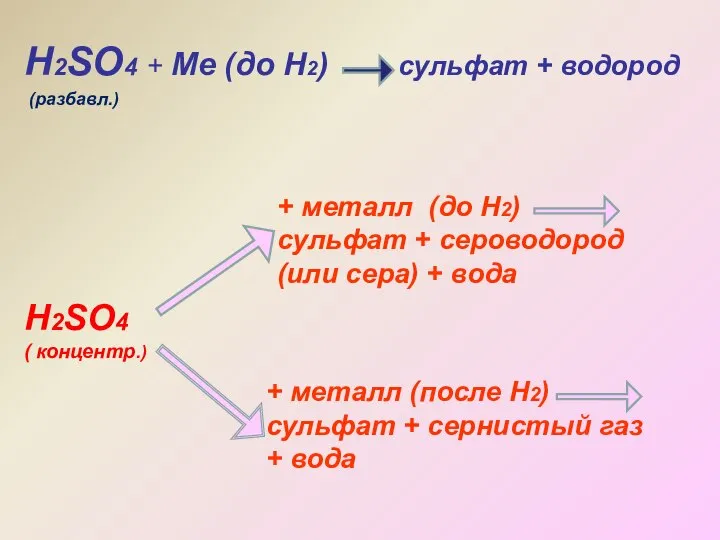
- 19. Н2SO4 + Ме (до Н2) сульфат + водород Н2SO4 ( концентр.) + металл (до Н2) сульфат
- 20. Выполните задание по вариантам: 1 вариант – сернистый газ 2 вариант – серная кислота Вам даны
- 21. Это простое вещество Это соединение с высшей степенью окисления серы 3. Это сильный электролит 4. Это
- 22. Сульфат меди(ll) Сульфат алюминия Сульфат бария Сульфат хрома(lll) Сульфат железа(ll) Сульфат кобальта Найдите соответствие между названием
- 23. Самостоятельная работа по вариантам:
- 24. 1 вариант 2 вариант Составить о.в.р: Серная кислота разб. + натрий 2. Серная кислота разб. +
- 26. Скачать презентацию




















 Разбор заданий на амины
Разбор заданий на амины Брейн-ринг. Відгадай елемент
Брейн-ринг. Відгадай елемент Липиды. Переваривание, всасывание, транспорт. (Лекция 8)
Липиды. Переваривание, всасывание, транспорт. (Лекция 8) Элементы 2 группы. Лекция № 2
Элементы 2 группы. Лекция № 2 Формирование информационно-коммуникативной компетенций у учащихся среднего звена на уроках химии
Формирование информационно-коммуникативной компетенций у учащихся среднего звена на уроках химии Азотная кислота
Азотная кислота Бутилацетат. Химическая формула бутилацетата
Бутилацетат. Химическая формула бутилацетата Фенол. Получение и использование, физические и химические свойства. Биологическая роль
Фенол. Получение и использование, физические и химические свойства. Биологическая роль Коллигативные свойства растворов
Коллигативные свойства растворов Химия в сельском хозяйстве
Химия в сельском хозяйстве Презентация по Химии "Тканини" - скачать смотреть бесплатно
Презентация по Химии "Тканини" - скачать смотреть бесплатно Утилизация отходов
Утилизация отходов Критерии оценки качества природного газа
Критерии оценки качества природного газа Эксперимент «Осадки и растворы»
Эксперимент «Осадки и растворы» Алкены.10 класс
Алкены.10 класс Материя и цвет. Свет
Материя и цвет. Свет Термодинамические возможности получения меди с применением программного комплекса АСТРА-4
Термодинамические возможности получения меди с применением программного комплекса АСТРА-4 Фосфор
Фосфор Расчет и построение кривых титрования в методе кислотно-основного титрования
Расчет и построение кривых титрования в методе кислотно-основного титрования Презентация по химии на тему: Бром
Презентация по химии на тему: Бром Общая характеристика углерода
Общая характеристика углерода Ароматические углеводороды. Процессы производства. Направления использования
Ароматические углеводороды. Процессы производства. Направления использования Хроматографические методы анализа. Метод газовой хроматографии
Хроматографические методы анализа. Метод газовой хроматографии Гидроксид железа
Гидроксид железа Что объединяет вещества. Классификация твёрдых веществ
Что объединяет вещества. Классификация твёрдых веществ Электролитическая диссоциация
Электролитическая диссоциация Эндогенная серия. Гидротермальная группа
Эндогенная серия. Гидротермальная группа Карбоновые кислоты
Карбоновые кислоты