Содержание
- 2. План 1. Введение в органическую химию. Теория строения А.М. Бутлерова. Основные понятия: гомологи, изомеры, радикалы, функциональные
- 3. п.1. Введение в органическую химию. Теория строения А.М. Бутлерова. Основные понятия: гомологи, изомеры, радикалы, функциональные группы,
- 4. 4
- 5. Теория строения органических веществ А.М. Бутлерова 1. Атомы в молекулах соединены друг с другом не беспорядочно,
- 6. Изомерия 6
- 7. Гомологи 7
- 8. п.2. Классификация органических веществ Классификация по типу углеродного скелета В зависимости от строения углеродного скелета органические
- 9. Классификация органических веществ (продол.) Классификация по типу функциональной группы В большинстве органических соединений, кроме атомов углерода
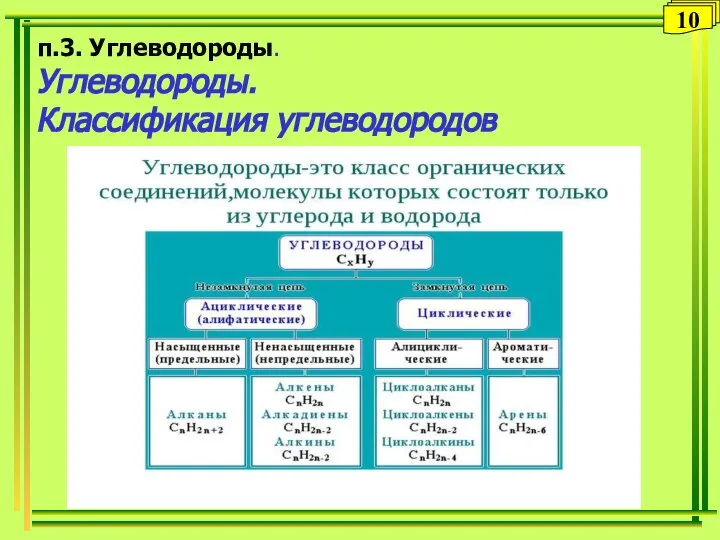
- 10. п.3. Углеводороды. Углеводороды. Классификация углеводородов 10
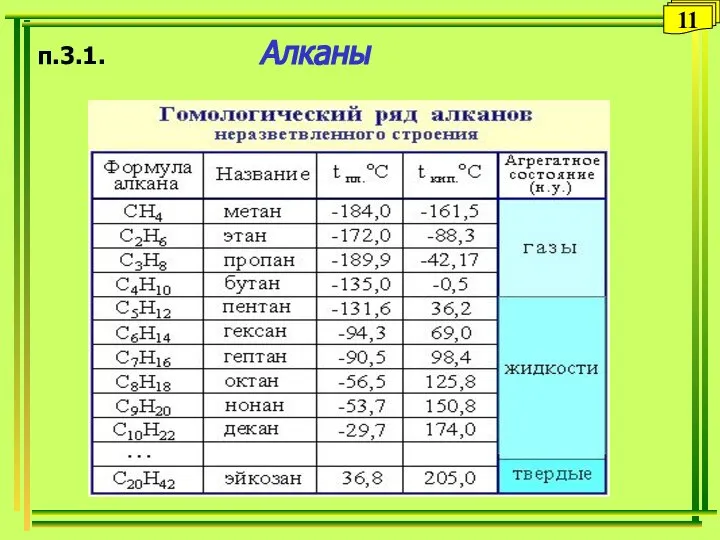
- 11. п.3.1. Алканы 11
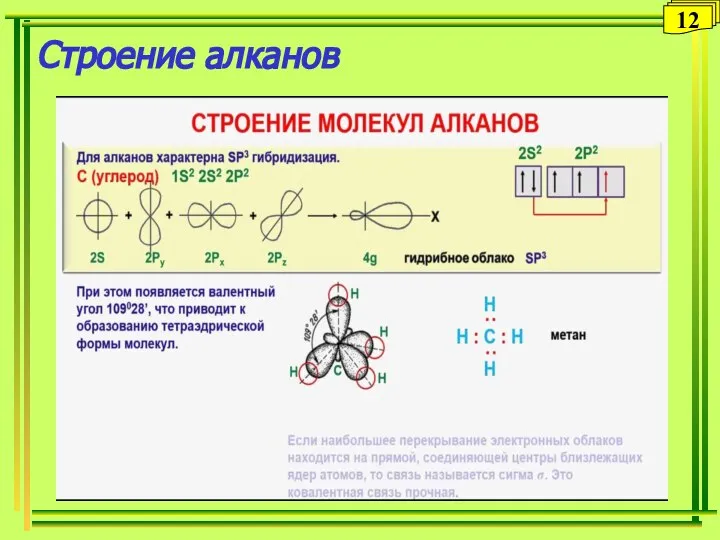
- 12. Строение алканов 12
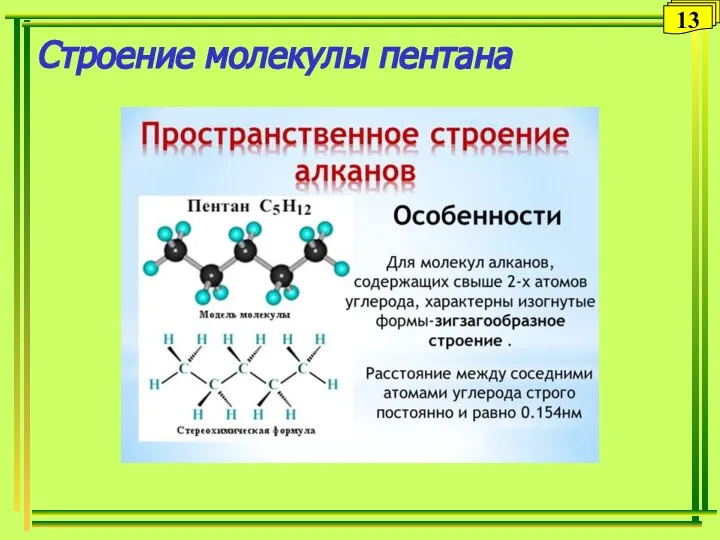
- 13. Строение молекулы пентана 13
- 14. Изомерия. Номенклатура Изомерия углеродного скелета ( у пентана 3 изомера: н-пентан, 2-метилбутан, 2,2-диметилпропан) Номенклатура 14
- 15. Методы получения алканов Алканы, как правило, получают разделением природных смесей углеводородов. Лабораторных способов получения немного: 1.
- 16. 16
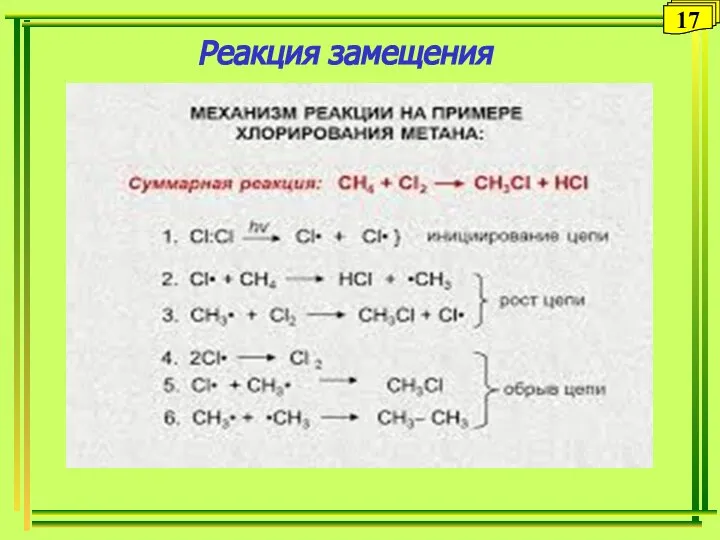
- 17. Реакция замещения 14 17
- 18. Непредельные углеводороды Непредельные, или ненасыщенные, УВ содержат кратные углерод- углеродные связи (двойные, тройные) Непредельными называются углеводороды,
- 19. Непредельные углеводороды, в молекулах которых содержится одна двойная связь. Общая формула гомологического ряда алкенов CnH2n. Гибридизация
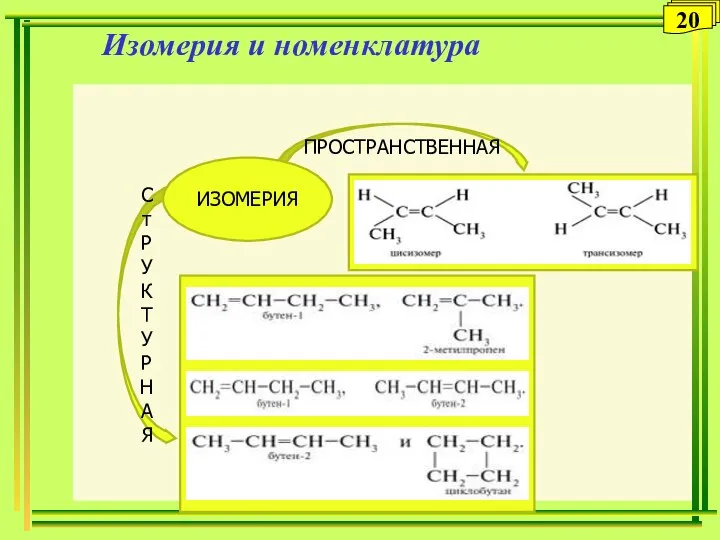
- 20. Изомерия и номенклатура С т Р У К Т У Р Н А Я ПРОСТРАНСТВЕННАЯ ИЗОМЕРИЯ
- 21. Методы получения алкенов 1. Дегидрирование алканов: Cr2O3, t Сn H2n+2 → Cn H2n + H2 2.
- 22. Химические свойства алкенов 1. Присоединение водорода: Н2С=СН2 + H2 → Н3С—СН3 2. Присоединение галогенов: Н2С=СН2 +
- 23. Правило Марковникова В.В. Водород галогенводорода присоединяется к более гидрогенизированному атому углерода при двойной связи, а галоген
- 24. Реакции окисления Горение: Н2С=СН2 + 3O2 → 2СO2 + 2Н2O Окисление перманганатом калия: 3H2C=CH2 + 2KMnO4
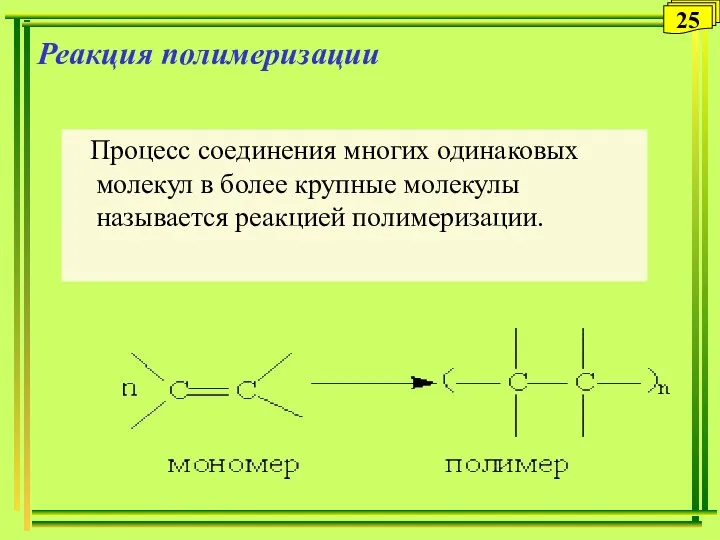
- 25. Реакция полимеризации Процесс соединения многих одинаковых молекул в более крупные молекулы называется реакцией полимеризации. 25
- 26. Алкадиены 26
- 27. Алкины. Ацетилен Алкины – углеводороды, содержащие кроме σ-связей две π-связи (тройную связь) у одной пары углеродных
- 28. Методы получения алкинов Общий способ получения алкинов – отщепление двух молекул галогеноводорода от дигалогеналканов, которые содержат
- 29. Химические свойства ацетилена 1.Реакция галогенирования CH≡CH + 2Br 2 → CHBr2−CHBr2 1,1,2,2-тетрабромэтан Алкины, так же как
- 30. Химические свойства ацетилена (прод.) 3. Реакция гидратации (реакция Кучерова) Вода присоединяется к алкинам с образованием неустойчивых
- 32. Скачать презентацию






















 Органічні сполуки і здоров’я людини. Жири, білки, вуглеводи, вітаміни як компоненти їжі, їх роль в організмі
Органічні сполуки і здоров’я людини. Жири, білки, вуглеводи, вітаміни як компоненти їжі, їх роль в організмі Гидрогенизационные процессы переработки нефти и газа
Гидрогенизационные процессы переработки нефти и газа Пластмассы, их классификация и применение
Пластмассы, их классификация и применение Вебинар. Гидролиз солей
Вебинар. Гидролиз солей Презентация по Химии "Виробництво сталі" - скачать смотреть бесплатно
Презентация по Химии "Виробництво сталі" - скачать смотреть бесплатно A laboratory examination of double replacement reaction
A laboratory examination of double replacement reaction Липиды. Классификация
Липиды. Классификация Химические свойства строительных материалов. Урок №5
Химические свойства строительных материалов. Урок №5 Роль хімії в природі
Роль хімії в природі Лекарственные и косметические средства из группы ароматических соединений
Лекарственные и косметические средства из группы ароматических соединений Простые вещества – металлы. Общие физические свойства металлов.
Простые вещества – металлы. Общие физические свойства металлов. Лекарственная форма порошки
Лекарственная форма порошки Моющие и чистящие средства
Моющие и чистящие средства Создание оптимального теплового режима в реакторах
Создание оптимального теплового режима в реакторах Соли и классы химических веществ
Соли и классы химических веществ Сырьё для получения фенолальдегидных полимеров
Сырьё для получения фенолальдегидных полимеров Минеральные вяжущие вещества и их назначение в строительстве. Классификация и номенклатура вяжущих веществ
Минеральные вяжущие вещества и их назначение в строительстве. Классификация и номенклатура вяжущих веществ Гальванические элементы
Гальванические элементы Углерод. 9 класс
Углерод. 9 класс Показники якості води Онуфреїв Оленка Слухач МАН Секція біологія.
Показники якості води Онуфреїв Оленка Слухач МАН Секція біологія. Предмет и метод термодинамики. Химическая термодинамика
Предмет и метод термодинамики. Химическая термодинамика Woda jako rozpuszczalnik
Woda jako rozpuszczalnik Изотопы, их свойства и применение
Изотопы, их свойства и применение Кислород. Получение кислорода и его физические свойства урок-презентация по химии 8 класс учитель: Видершпан И.П.
Кислород. Получение кислорода и его физические свойства урок-презентация по химии 8 класс учитель: Видершпан И.П.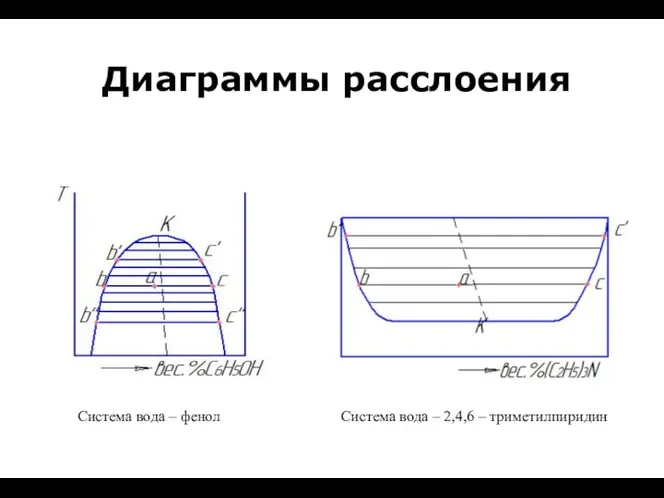 Диаграммы расслоения
Диаграммы расслоения Строение и свойства белков
Строение и свойства белков Презентация ОБЩАЯ ЖЕСТКОСТЬ ВОДЫ
Презентация ОБЩАЯ ЖЕСТКОСТЬ ВОДЫ  Целлюлоза
Целлюлоза