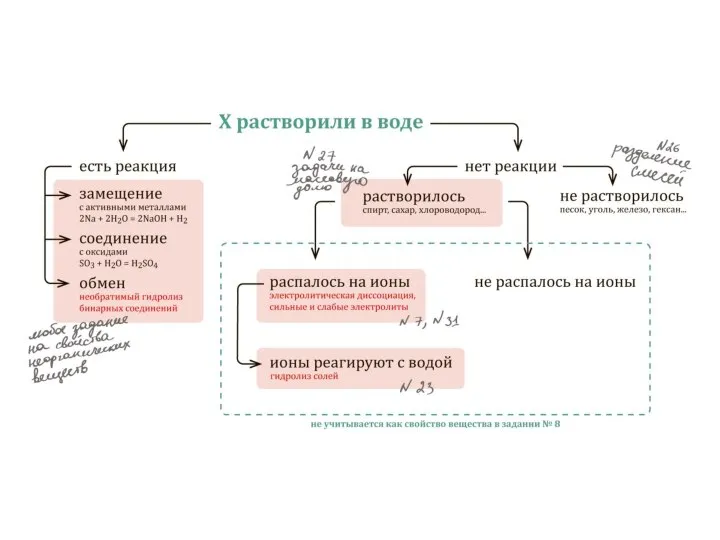
Содержание
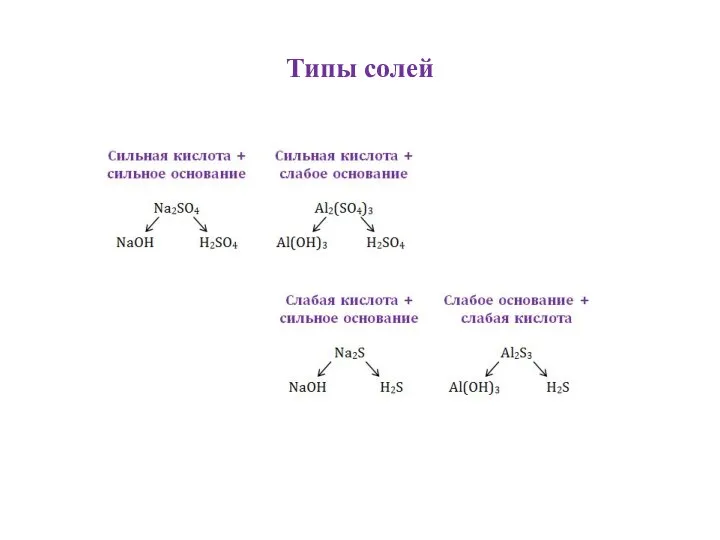
- 4. Типы солей
- 5. Сильные основания Сильные кислоты Правило Полинга HaXOb b – a = 0 или 1 – слабая
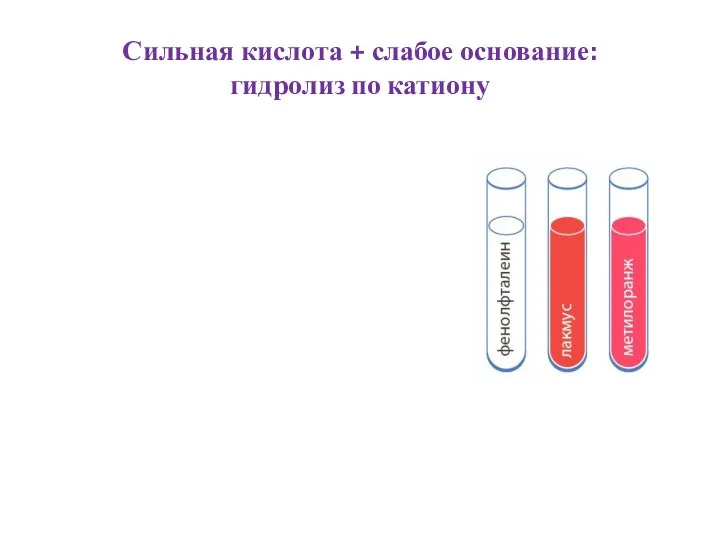
- 6. Сильная кислота + слабое основание: гидролиз по катиону
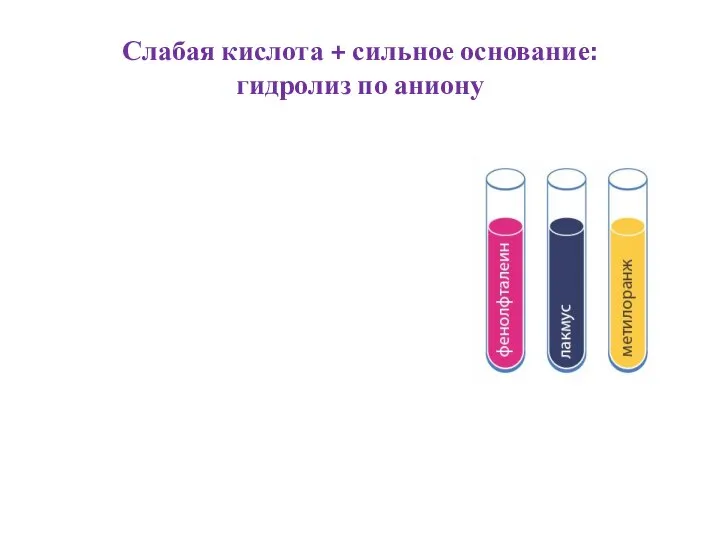
- 7. Слабая кислота + сильное основание: гидролиз по аниону
- 8. Слабая кислота + слабое основание: гидролиз по аниону и по катиону Существующие соли Некоторые «?» и
- 9. Ловушки в тестах «Н» соли не гидролизуются
- 10. Ловушки в тестах среда растворов кислых солей активных металлов: кислая щелочная HSO4–, H2PO4– HS –, HCO3–,
- 16. Распознавание солей
- 17. Совместный гидролиз
- 18. Совместный гидролиз в заданиях ЕГЭ № 32. Оксид железа (III) растворили в соляной кислоте. К полученному
- 19. Совместный гидролиз в заданиях ЕГЭ № 32. Натрий растворили в воде. Через полученный раствор пропустили недостаток
- 20. Совместный гидролиз в заданиях ЕГЭ
- 22. Скачать презентацию















 Презентация на тему: Кислотные дожди
Презентация на тему: Кислотные дожди Химиялық тепе-теңдік және оның ығысуына әсер етуші жағдайлар. Ле Шателье-Браун принциптері
Химиялық тепе-теңдік және оның ығысуына әсер етуші жағдайлар. Ле Шателье-Браун принциптері Методы разделения белковых смесей. Электрофорез
Методы разделения белковых смесей. Электрофорез Основные классы органических соединений. Углеводороды
Основные классы органических соединений. Углеводороды Многоатомные спирты
Многоатомные спирты Кислород. Свойства кислорода
Кислород. Свойства кислорода Презентация Витамин Е
Презентация Витамин Е  ZnS и ZnSe как оптические материалы,люминофоры, лазерные матрицы
ZnS и ZnSe как оптические материалы,люминофоры, лазерные матрицы Строение атома, изотопы
Строение атома, изотопы Методические проблемы преподавания органической химии и ее основные теоретические понятия
Методические проблемы преподавания органической химии и ее основные теоретические понятия Состав краски
Состав краски Биополимеры
Биополимеры "Металлы тоже воевали…" урок по химии в 8 классе Учитель Герасименко Е.В.
"Металлы тоже воевали…" урок по химии в 8 классе Учитель Герасименко Е.В. Группы атомов водорода (12 групп)
Группы атомов водорода (12 групп) Аттестационная работа. Методразработка по проведению исследовательской работы Выращивание кристаллов в домашних условиях
Аттестационная работа. Методразработка по проведению исследовательской работы Выращивание кристаллов в домашних условиях Важнейшие химические понятия и законы
Важнейшие химические понятия и законы Кристалічні та аморфні тіла. Рідкі кристали та їх властивості. Підготувала учениця 10 класу Стрельчук Катерина
Кристалічні та аморфні тіла. Рідкі кристали та їх властивості. Підготувала учениця 10 класу Стрельчук Катерина  Арены и ароматичность
Арены и ароматичность Кинетика сложных реакций
Кинетика сложных реакций Полимеры. Каучуки. Резина
Полимеры. Каучуки. Резина Номенклатура органических соединений. Структурные формулы соединений. Алканы. (Лабораторная работа 2)
Номенклатура органических соединений. Структурные формулы соединений. Алканы. (Лабораторная работа 2) Природный каучук
Природный каучук Реакции ионного обмена
Реакции ионного обмена Презентация по Химии "Глюкоза. Строение. Физические и химические свойства" - скачать смотреть
Презентация по Химии "Глюкоза. Строение. Физические и химические свойства" - скачать смотреть  Презентация по Химии "Алюминий и его соединения" - скачать смотреть
Презентация по Химии "Алюминий и его соединения" - скачать смотреть  Алкалоиды, производные тропана
Алкалоиды, производные тропана Дисахариды и полисахариды
Дисахариды и полисахариды Анілін. Фізичні властивості
Анілін. Фізичні властивості