ОСНОВАНИЯ, ИХ КЛАССИФИКАЦИЯ И СВОЙСТВА Составил: учитель химии МОУ «Средняя общеобразовательная школа №92 с углубленным изуче
Содержание
- 3. КЛАССИФИКАЦИЯ ОСНОВАНИЙ
- 4. Гидроксид аммония Гидра́т аммиа́ка (гидрокси́д аммо́ния, аммиа́чная вода́) — соединение, образующееся при взаимодействии аммиака с водой
- 5. ОСНОВАНИЯ сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (-OH). В водном
- 6. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ При взаимодействии с кислотой образуется соль и вода: NaOH + HCl → NaCl
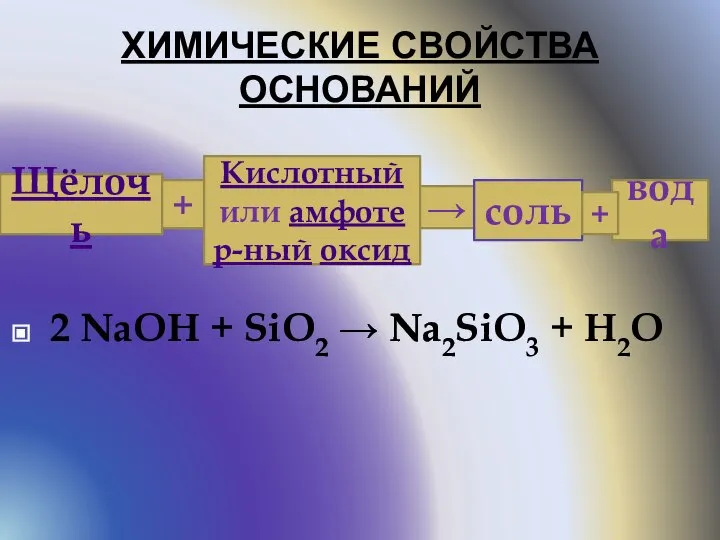
- 7. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ 2 NaOH + SiO2 → Na2SiO3 + H2O Щёлочь + Кислотный или амфотер-ный
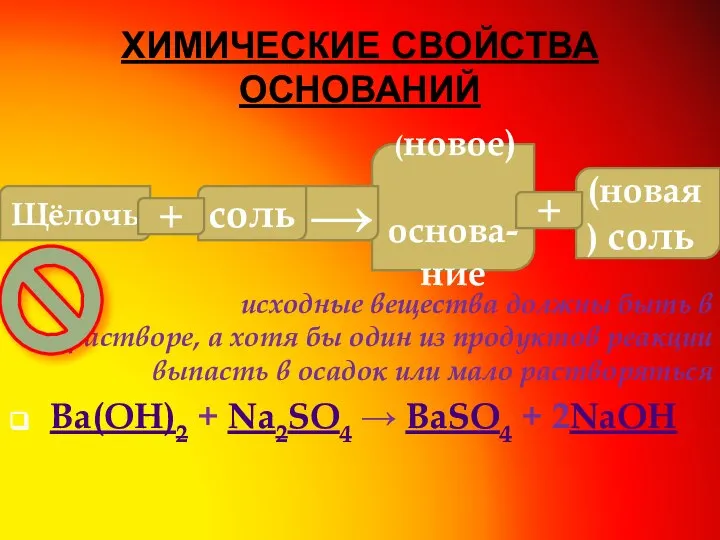
- 8. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ исходные вещества должны быть в растворе, а хотя бы один из продуктов реакции
- 9. Получение гидроксида меди (II) Сu2+ + 2OH- =Cu(OH)2↓
- 10. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ Слабые основания при нагревании разлагаются: t Cu(OH)2 CuO + H2O
- 11. ЛАКМУС МЕТИЛОВЫЙ ФЕНОЛФТА- ОРАНЖЕВЫЙ ЛЕИН ОКРАСКА ИНДИКАТОРОВ В ЩЕЛОЧНОЙ СРЕДЕ
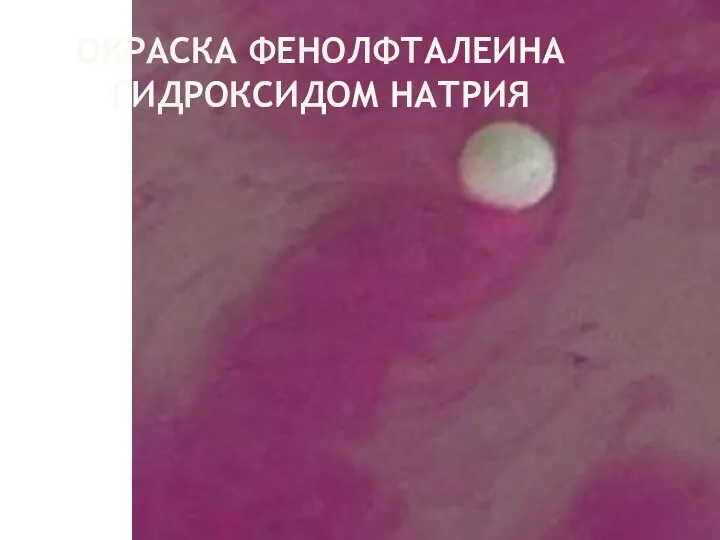
- 12. ОКРАСКА ФЕНОЛФТАЛЕИНА ГИДРОКСИДОМ НАТРИЯ
- 13. ПРИМЕНЕНИЕ ЩЕЛОЧЕЙ
- 15. Скачать презентацию









 Свойства простых веществ 8 класс
Свойства простых веществ 8 класс Элементы равновесной электрохимии, ионоселективные электроды
Элементы равновесной электрохимии, ионоселективные электроды Соединения алюминия
Соединения алюминия Алканы. Физические и химические свойства
Алканы. Физические и химические свойства Физическая технология топлива. Направления переработки нефти. Классификация нефтепродуктов
Физическая технология топлива. Направления переработки нефти. Классификация нефтепродуктов Презентация по химии Амины
Презентация по химии Амины Презентация по Химии "Самодельная грелка" - скачать смотреть
Презентация по Химии "Самодельная грелка" - скачать смотреть  Общие представления об электрохимических технологиях
Общие представления об электрохимических технологиях Смазочные материалы. Моторные масла
Смазочные материалы. Моторные масла ИЗОМЕРИЯ И СТРОЕНИЕ КС. СПОСОБНОСТЬ АТОМОВ РАЗЛИЧНЫХ ЭЛЕМЕНТОВ К КОМПЛЕКСООБРАЗОВАНИЮ. УСТОЙЧИВОСТЬ КС Лектор: канд. хим. н
ИЗОМЕРИЯ И СТРОЕНИЕ КС. СПОСОБНОСТЬ АТОМОВ РАЗЛИЧНЫХ ЭЛЕМЕНТОВ К КОМПЛЕКСООБРАЗОВАНИЮ. УСТОЙЧИВОСТЬ КС Лектор: канд. хим. н Изучение слёзного аппарата человека, функций плача и состав слёз
Изучение слёзного аппарата человека, функций плача и состав слёз Физические свойства полимеров
Физические свойства полимеров Общая характеристика элементов VIA-группы (халькогены). Сера. Кислород
Общая характеристика элементов VIA-группы (халькогены). Сера. Кислород Анализ пищевых добавок (маркировка Е) используемых в продуктовой линейке Витамакс
Анализ пищевых добавок (маркировка Е) используемых в продуктовой линейке Витамакс Определение предмета биофизики
Определение предмета биофизики Органічна хімія
Органічна хімія Гелий. Физико-химические свойства
Гелий. Физико-химические свойства Алканы. Алканы.
Алканы. Алканы. Заттардың агрегаттық күйлері
Заттардың агрегаттық күйлері Скорость химических реакций. Факторы, влияющие на скорость химических реакций
Скорость химических реакций. Факторы, влияющие на скорость химических реакций Хлороводород..Соляная кислота
Хлороводород..Соляная кислота Применение дидактических игр на уроках химии
Применение дидактических игр на уроках химии Определение исходного металла. Решение задачи алгебраическим методом. Исайкин Александр Михайлович учитель химии МОУ «СОШ
Определение исходного металла. Решение задачи алгебраическим методом. Исайкин Александр Михайлович учитель химии МОУ «СОШ  Нуклеофильное замещение галогена и других функциональных групп
Нуклеофильное замещение галогена и других функциональных групп 140 лет дому, который построил Д.И. Менделеев
140 лет дому, который построил Д.И. Менделеев Сера
Сера Растворы. Способы выражения концентрации растворенного вещества
Растворы. Способы выражения концентрации растворенного вещества Презентация Элементы таблицы Менделеева
Презентация Элементы таблицы Менделеева