Содержание
- 2. Задание для студентов на период с 04.02.2022. Познакомьтесь с материалом данной презентации, составьте конспект. Выполните в
- 3. Основные классы неорганических веществ Оксиды; Основания; Кислоты; Соли
- 4. оксиды Металл+ (Ме+) и кислород (О-2) Неметалл + и кислород (О-2) Оксиды – это сложные вещества,
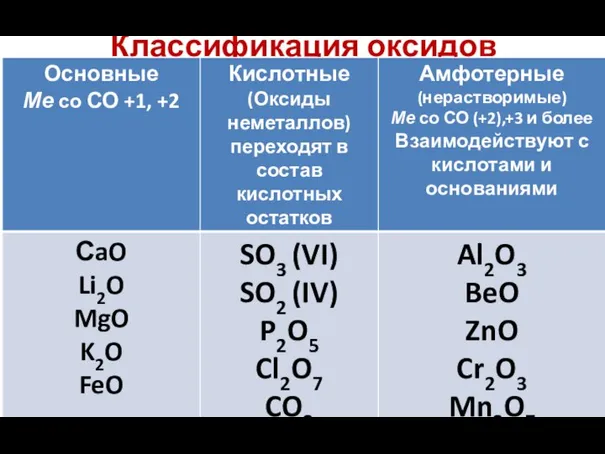
- 5. Классификация оксидов
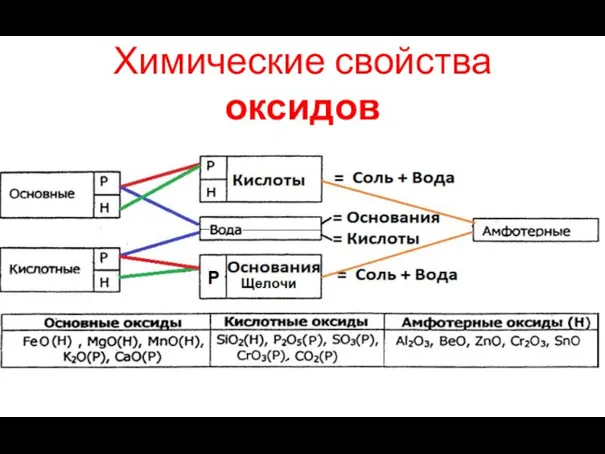
- 6. Химические свойства оксидов
- 7. Задание № 1. Запишите уравнения реакций следующих взаимодействий, назовите все вещества (вещества подберите сами): Растворимый основный
- 8. Основание (гидроксиды) - металл+ и ОН- Растворимые в воде основания – ЩЕЛОЧИ Щелочные металлы – Li,
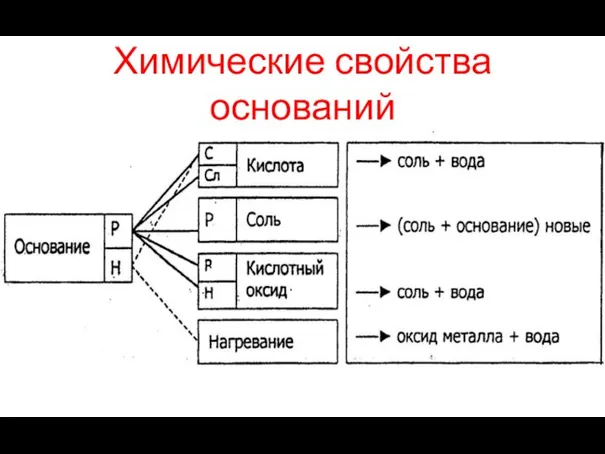
- 9. Химические свойства оснований
- 10. Задание № 2. Запишите уравнения реакций следующих взаимодействий, назовите все вещества (вещества подберите сами): Нерастворимое основание
- 11. КИСЛОТЫ Кислота – Н+ и кислотный остаток- Кислоты – это сложные вещества, содержащие атомы водорода и
- 12. Названия кислородсодержащих кислот производится от названия неметалла с прибавлений окончаний – ная или – вая, если
- 13. Названия бескислородных кислот производятся от названия неметалла с окончанием «О» и прибавлением слова «водородная» HCl –
- 14. Сильные кислоты (ЗАПОМНИТЬ): НCl - соляная НClO4 - хлорная НBr - бромоводородная НI - иодоводородная Н2SO4
- 15. кислоты (ЗАПОМНИТЬ): HF – фтороводородная кислота или плавиковая H2S – сероводородная кислота (очень летучая) H2SO3 –
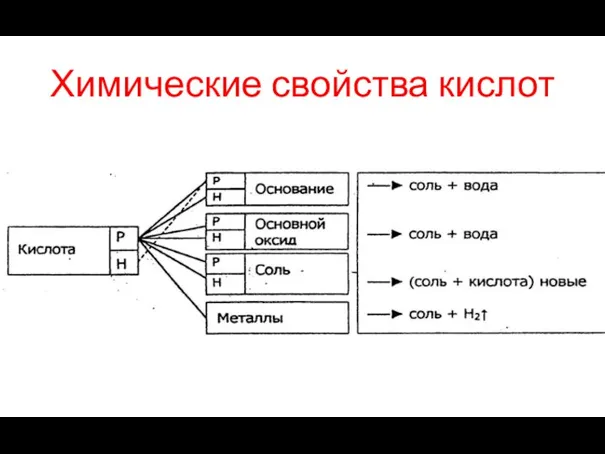
- 16. Химические свойства кислот
- 17. Задание № 3. Запишите уравнения реакций следующих взаимодействий, назовите все вещества (вещества подберите сами): Кислота +
- 18. Кислотные остатки (ЗАПОМНИТЬ): Cl- - хлорид ClO4- - перхлорат Br- - бромид I- - иодид SO42-
- 19. СОЛИ Соль – Металл+ и кислотный остаток- Соли - это сложные вещества, содержащие атомы металла и
- 20. Классификация солей: Средние (нормальные) - Кислые H+ (гидро…) - Основные OH- (гидроксо…)
- 21. Средние соли Продукты полного замещения атомов водорода в кислотах металлами, т.е. их молекулы состоят из атомов
- 22. Кислые соли Продукт неполного замещения атомов водорода на металл, т.е.в молекулах остался водород от кислоты (гидро)
- 23. Кислые соли Na H2PO4 - дигидрофосфат натрия Na2 H PO4 - гидрофосфат натрия Ba2+(HCO3)-2 - гидрокарбонат
- 24. Основные соли Продукт неполного замещения гидроксогрупп оснований кислотными остатками, т.е. их молекулы содержат гидроксогруппы. OH Cl
- 25. Основные соли Русское название: как средние с добавлением слова «основной» Al(OH)2 NO3 – основной нитрат алюминия
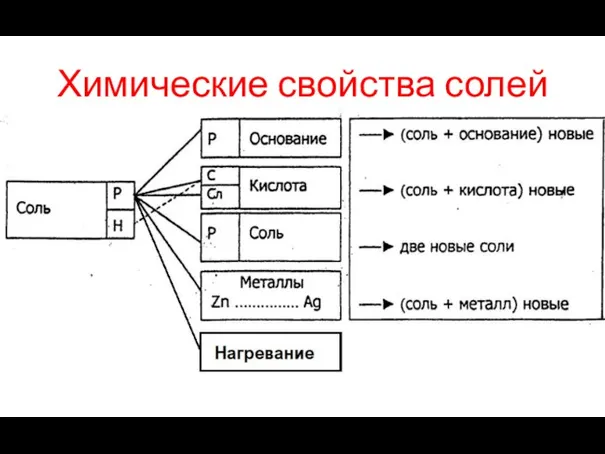
- 26. Химические свойства солей
- 27. Задание № 4. Запишите уравнения реакций следующих взаимодействий, назовите все вещества (вещества подберите сами): Соль +
- 28. Задание № 5 HSO4, CaO, HCl, Fe(OH)2, Fe(OH), KPO4, HCO3, Ca(OH), SO, HNO3, KCO3, CuSO4, CuO,
- 29. 3. С какими из указанных веществ будет взаимодействовать NaOH: СuO, H2O, H2SO4, CO2, Cu(OH)2, Al(NO3)3 Запишите
- 30. 5. Распределите соли по соответствующим графам, дайте им название. Al2(SO4)3, AlOHSO4, BaCO3, NaH2PO4, Na2S, Mg(HS)2, Na2HPO4,
- 31. 6. Напишите уравнения реакций, назовите все вещества: CaCl2 + AgNO3 = K2SO4 + BaCl2 = 7.
- 32. 8. Ряд превращений неорганических веществ (образец): 1 2 3 4 Cu →CuO →CuSO4 →Cu(OH)2 →CuO Ставим
- 34. Скачать презентацию


























 Презентация по Химии "Органічні сполуки і здоров’я людини." - скачать смотреть бесплатно
Презентация по Химии "Органічні сполуки і здоров’я людини." - скачать смотреть бесплатно Химическая связь
Химическая связь Використання кислот в будівництві і побуті. 8 клас
Використання кислот в будівництві і побуті. 8 клас Способи добування алкінів Презентація Учениці 11-А класу Гаджук Зорини
Способи добування алкінів Презентація Учениці 11-А класу Гаджук Зорини  Круговорот азота в природе
Круговорот азота в природе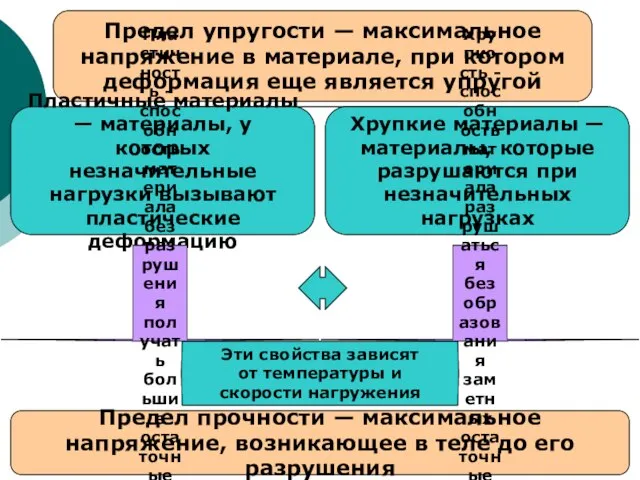 Предел упругости
Предел упругости Сульфаттар және эфирсульфаттар
Сульфаттар және эфирсульфаттар Загальна характеристика неметалічних елементів. Неметали як прості речовини. Явище алотропії, алотропні видозміни Оксигену і
Загальна характеристика неметалічних елементів. Неметали як прості речовини. Явище алотропії, алотропні видозміни Оксигену і Волокна Презентація на тему:
Волокна Презентація на тему:  Кристаллические решетки
Кристаллические решетки Презентація на тему: Каучуки Виконав: Учень 11-Б класу Путьо Михайло
Презентація на тему: Каучуки Виконав: Учень 11-Б класу Путьо Михайло  Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) 6-членные гетероциклы с одним гетероатомом
6-членные гетероциклы с одним гетероатомом Презентация по Химии "СИММЕТРИЯ В ХИМИИ" - скачать смотреть
Презентация по Химии "СИММЕТРИЯ В ХИМИИ" - скачать смотреть  Химия тория и протактиния
Химия тория и протактиния Степень диссоциации. 9 класс
Степень диссоциации. 9 класс Физические и химические явления
Физические и химические явления Синтез метилового эфира цинкофорина
Синтез метилового эфира цинкофорина Белки. Функции белков
Белки. Функции белков Виды изомерии. Углеводороды
Виды изомерии. Углеводороды Lead
Lead Органические и неорганические полимеры
Органические и неорганические полимеры Основные классы неорганических веществ
Основные классы неорганических веществ Над проектом работали ученики 6 класса: Над проектом работали ученики 6 класса: Крючков Слава Орлов Слава Старова Катя Пугачев Се
Над проектом работали ученики 6 класса: Над проектом работали ученики 6 класса: Крючков Слава Орлов Слава Старова Катя Пугачев Се 8 класс (обязательный минимум по химии) Теория электролитической диссоциации (ТЭД). Урок 1
8 класс (обязательный минимум по химии) Теория электролитической диссоциации (ТЭД). Урок 1 Подготовка учащихся к выполнению заданий различного уровня сложности ЕГЭ по химии
Подготовка учащихся к выполнению заданий различного уровня сложности ЕГЭ по химии Мир химических элементов
Мир химических элементов Адам ағзасындағы химиялық элементтер
Адам ағзасындағы химиялық элементтер