Содержание
- 2. План 1. Основные понятия теории фазовых равновесий. 2. Фазовые диаграммы однокомпонентных систем 3. Уравнение Клаузиса-Клайперона и
- 3. 1. Основные понятия теории фазовых равновесий
- 4. Фаза (Ф) - однородная часть системы, обладающая одинаковым составом, физическими и химическими свойствами, которая может быть
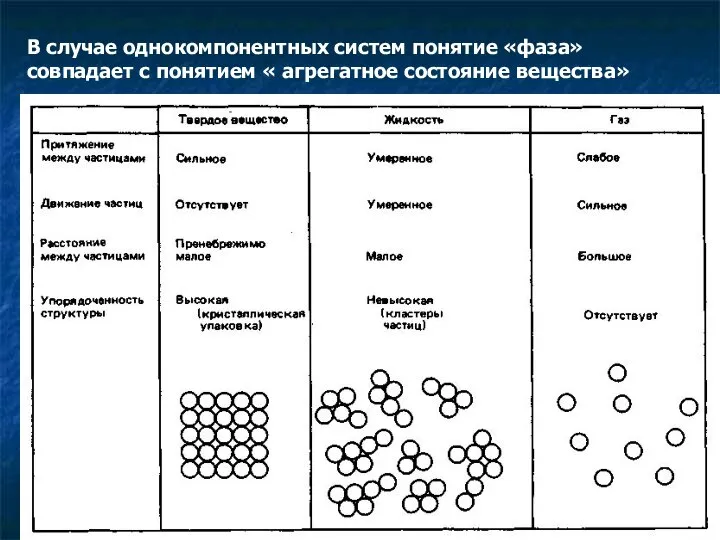
- 5. В случае однокомпонентных систем понятие «фаза» совпадает с понятием « агрегатное состояние вещества»
- 6. В случае многокомпонентных систем число жидких фаз равно числу жидкостей различного состава, образующих отдельные слои или
- 7. Число компонентов (К) – наименьшее количество составляющих веществ, достаточное для определения состава любой фазы системы. Если
- 9. Фазовые переходы – переход вещества из одной фазы в другую. Фазовые переходы 1-го рода –характеризуются постоянной
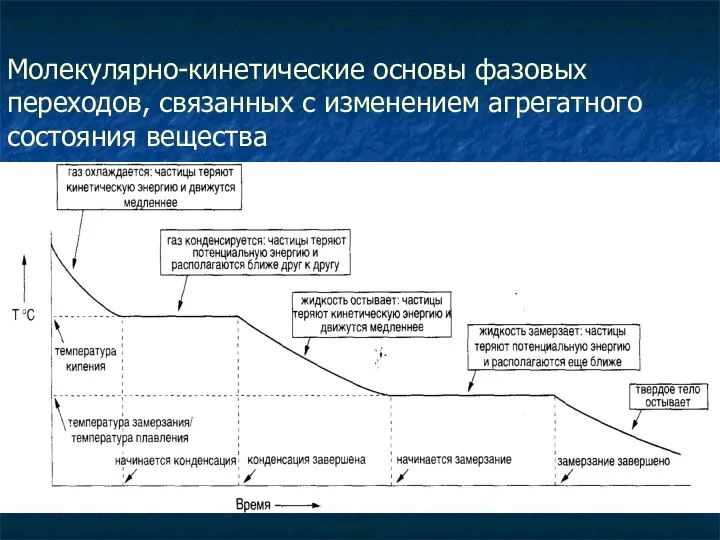
- 10. Молекулярно-кинетические основы фазовых переходов, связанных с изменением агрегатного состояния вещества
- 11. Фазовые равновесия – равновесия в гетерогенных системах, в которых происходят фазовые переходы. В момент равновесия наблюдается:
- 13. Температура плавления Тпл, К- температура, которая соответствует фазовому равновесию Т⇄Ж, при постоянном давлении она устанавливается от
- 14. Возможности перехода вещества из одного фазового состояния в другое определяется правилом фаз Гиббса, которое является выражением
- 15. Число степеней свободы (С) определяется как число параметров системы (температура, давление и др.), которые могут быть
- 16. ДЗ: Вывод правила фаз Гиббса (Н.Н. Мушкамбаров Физическая и коллоидная химия. С. 66 – 67)
- 17. Правило фаз Гиббса позволяет определить максимальное число фаз в момент равновесия; определить наименьшее число параметров, необходимых
- 18. Фазовые диаграммы – графическое изображение условий фазовых равновесий. Фазовые диаграммы изображают в координатах Р— Т—х, где
- 19. В основе анализа диаграмм лежат два принципа: 1) принцип непрерывности: при непрерывном изменении параметров, определяющих состояние
- 20. 2. Фазовые диаграммы однокомпонентных систем и их анализ.
- 21. Примером однокомпонентной системы может служить простое вещество или химическое соединение, обладающее строго определенным составом во всех
- 22. Способы измерений давления пара 1) Для малолетучих веществ часто пользуются методом увлечения., заключающимся в том, что
- 23. Способы измерений давления пара 3) К веществам средней летучести применяют динамический метод, основанный на том, что
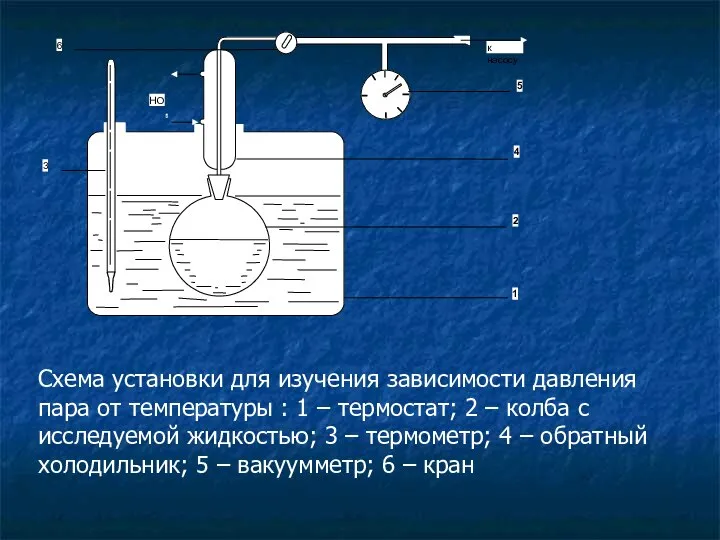
- 24. Схема установки для изучения зависимости давления пара от температуры : 1 – термостат; 2 – колба
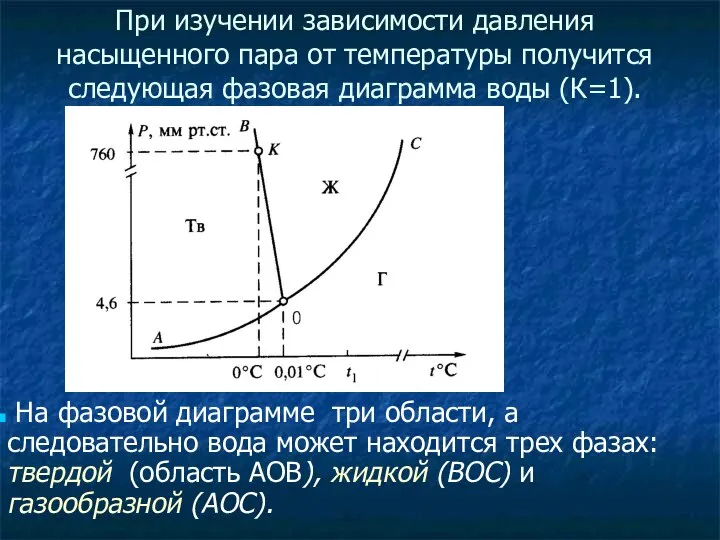
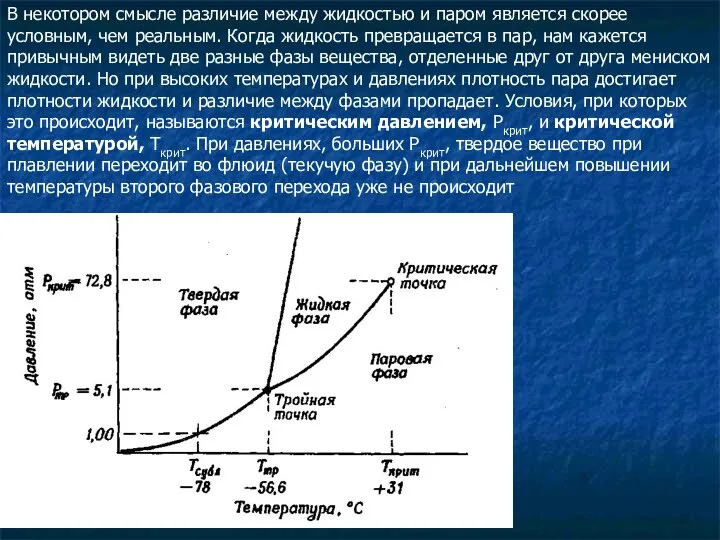
- 25. При изучении зависимости давления насыщенного пара от температуры получится следующая фазовая диаграмма воды (К=1). На фазовой
- 26. Линия ОС — линия испарения (Ж ⇄ Г). она выражает зависимость давления насыщенного пара над жидкой
- 27. Линия OB — кривая плавления (Т ⇄ Ж). При р=760 мм. рт. ст. плавление льда начинается
- 28. Анализ на основе правила фаз Гиббса: Если фигуративная точка лежит в плоскости между линиями, то система
- 29. В некотором смысле различие между жидкостью и паром является скорее условным, чем реальным. Когда жидкость превращается
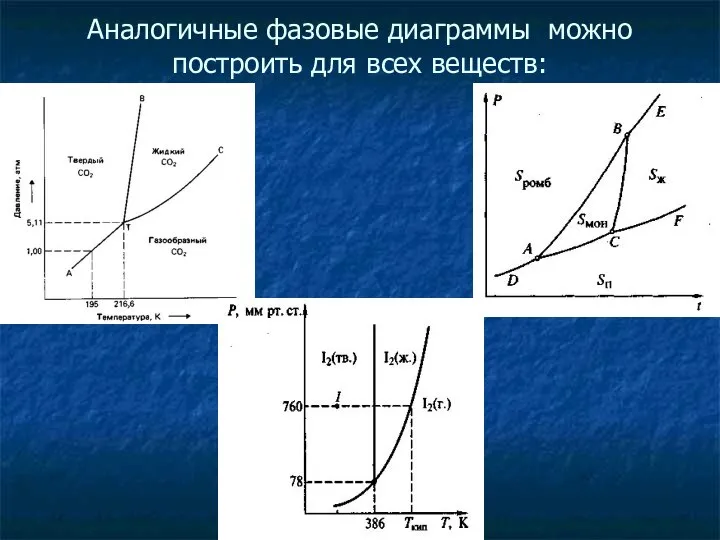
- 30. Аналогичные фазовые диаграммы можно построить для всех веществ:
- 31. 3. Уравнение Клаузиса – Клайперона и анализ на его основе фазовой диаграммы воды
- 32. ДЗ: Вывод уравнения Клаузиса-Клайперона (Н.Н. Мушкамбаров Физическая и коллоидная химия. с74-75.)
- 33. Уравнение Клаузиса-Клайперона –уравнение, которое описывает ход кривых на диаграмме состояния однокомпонентных систем. где ΔH — теплота
- 34. Уравнение Клайперона- Клаузиса позволяет определять наклоны кривых равновесия. Наклон задается знаком (V2-V1), так как ΔH и
- 35. Применение уравнения Клаузиса –Клайперона к равновесиям Ж⇄Г,Т⇄Г При изучении процессов испарения и возгонки в первую очередь
- 36. В любой точке линии равновесия любых двух фаз, начерченной в координатах Т- р тангенс угла наклона
- 37. Для количественных расчетов уравнение Клаузиса –Клайперона интегрируют и получают следующие уравнение в интегральной форме. Для этого
- 38. Интегрируя это уравнение в не очень широком интервале температур, будем считать, что в этом интервале ΔH
- 40. 2). Определенное интегрирование На основе интегрированного уравнения можно определить: давление насыщенного пара при различных температурах, если
- 41. Если тепловой эффект фазового перехода зависит от температуры ΔH ф.п. =f (Т) , то применяют уравнение
- 42. Применение уравнения Клаузиса –Клайперона к равновесиям Т⇄Ж В этом случае уравнение Клаузиса-Клайперона примет вид: ΔHпл>0, ΔТпл>0,
- 44. Скачать презентацию



































 Квест с Гарри Поттером
Квест с Гарри Поттером Мило. Мийні засоби
Мило. Мийні засоби Презентация по Химии "Первоначальные химические понятия" - скачать смотреть
Презентация по Химии "Первоначальные химические понятия" - скачать смотреть  Структура периодической системы элементов
Структура периодической системы элементов Теория создание стекла, оптические кристаллы
Теория создание стекла, оптические кристаллы Композиты. Полимерные композиционные материалы
Композиты. Полимерные композиционные материалы Альдегиды
Альдегиды Металлические сплавы
Металлические сплавы Минералы
Минералы Генетическая связь веществ. Виды реакций
Генетическая связь веществ. Виды реакций Путешествие в мир химии познавательная игра по химии, 8 класс Автор: Лаврентьева Снежана Павловна, учитель химии и биологии
Путешествие в мир химии познавательная игра по химии, 8 класс Автор: Лаврентьева Снежана Павловна, учитель химии и биологии  Гормоны. Виды и классификация гормонов
Гормоны. Виды и классификация гормонов Хлор
Хлор Излучение и поглощение света атомами. Виды спектров, спектральный анализ
Излучение и поглощение света атомами. Виды спектров, спектральный анализ Нефть. Свойства нефти
Нефть. Свойства нефти Алкины
Алкины Влияние нанокомпозитов платина/Нафион на электрокаталитическую активность реакции восстановления водорода и окисления кислород
Влияние нанокомпозитов платина/Нафион на электрокаталитическую активность реакции восстановления водорода и окисления кислород Методы экстрагирования ЛРС и оборудование
Методы экстрагирования ЛРС и оборудование Технология производства химических волокон. Свойства химических волокон. 7 класс
Технология производства химических волокон. Свойства химических волокон. 7 класс Біохімічний склад кормів - первинний показник їх технологічної й продуктивної можливості
Біохімічний склад кормів - первинний показник їх технологічної й продуктивної можливості Физико-химические методы анализа
Физико-химические методы анализа Введение в органическую химию
Введение в органическую химию Возможные роли АФК в старении
Возможные роли АФК в старении Химические свойства оксидов
Химические свойства оксидов Амины. Номенклатура аминов
Амины. Номенклатура аминов Vodík
Vodík History of radioactivity
History of radioactivity История появления новогодней открытки
История появления новогодней открытки