Содержание
- 2. Определение Ами́ны — органические соединения, являющиеся производными аммиака, в молекуле которого один, два или три атома
- 3. Номенклатура 1) Название радикала + амин CH 3 – NH 2 – Метиламин CH 3 –
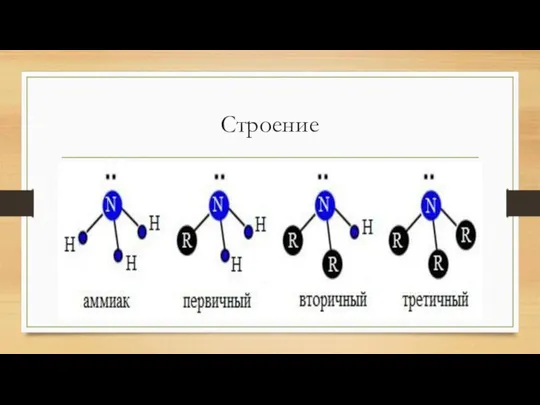
- 4. Строение
- 5. Классификация По числу замещённых атомов H Первичные CH 3 – NH 2 – Метиламин Вторичные CH
- 6. Классификация По типу R Предельные C2H5 – NH2 – Этиламин Ароматические C6H5 – NH 2 –
- 7. Структурная изомерия а) изомерия углеродного скелета:
- 8. изомерия положения функциональной группы:
- 9. межклассовая изомерия
- 10. Физические свойства аминов Простейшие амины (метиламин, диметиламин, триметиламин) — газообразные вещества. Остальные низшие амины — жидкости,
- 11. Химические свойства аминов Химические свойства аминов определяются в основном наличием у атома азота неподеленной электронной пары.
- 13. Реакция амионов с водой приводит к образованию гидроксид-ионов
- 14. Реакция с кислотами
- 15. Горение амионов
- 16. Получение Синтез из спиртов. Пропусканием паров спирта и аммиака при 400 0С над катализатором получают смесь
- 17. Реакция Гофмана. Действие аммиака на галогенопроизводные позволяет получить смесь солей различных аминов:
- 18. Реакция Зинина Нитросоединения восстанавливаются водородом в присутствии катализатора:
- 19. Синтез из амидов кислот:
- 20. Взаимодействие хлорбензола с аммиаком:
- 22. Скачать презентацию


















 Фосфонсірке қышқылының антипирендік қасиеттерін зерттеу
Фосфонсірке қышқылының антипирендік қасиеттерін зерттеу Тест 1.Тип кристаллической решетки у белого фосфора…. а) молекулярный б) атомный в) ионный а) молекулярный Р4 2. У фосфора….. аллотропных модификаций а) две б) три в) четыре г) пять в) четыре – белый, черный, красный, фиолетовый 3.
Тест 1.Тип кристаллической решетки у белого фосфора…. а) молекулярный б) атомный в) ионный а) молекулярный Р4 2. У фосфора….. аллотропных модификаций а) две б) три в) четыре г) пять в) четыре – белый, черный, красный, фиолетовый 3.  Простые и сложные вещества Звонарёва Т.И. Учитель биологии МОУ лицей Г. Электрогорск
Простые и сложные вещества Звонарёва Т.И. Учитель биологии МОУ лицей Г. Электрогорск Получение металлов
Получение металлов Полібутадієновий та поліізопреновий каучуки
Полібутадієновий та поліізопреновий каучуки Тема 1. Обработка вооружения, техники и обмундирования. Дегазирующие, дезактивирующие и дезинфицирующие вещества и растворы
Тема 1. Обработка вооружения, техники и обмундирования. Дегазирующие, дезактивирующие и дезинфицирующие вещества и растворы Структурно-механiчнi (реологiчнi) властивостi харчових мас
Структурно-механiчнi (реологiчнi) властивостi харчових мас Курс лекций по химии
Курс лекций по химии Задача №5. Аккумулятор на основе железа
Задача №5. Аккумулятор на основе железа Көмірсулар
Көмірсулар Полимеры
Полимеры Полімери. Поліетилен.
Полімери. Поліетилен.  Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады) Области применения лития
Области применения лития Презентация по Химии "Хімія в медицині" - скачать смотреть бесплатно
Презентация по Химии "Хімія в медицині" - скачать смотреть бесплатно Работы Вильгема Оствальда. Проблема топливных элементов
Работы Вильгема Оствальда. Проблема топливных элементов МЫЛО
МЫЛО ГАЛОГЕНЫ И ИХ СОЕДИНЕНИЯ
ГАЛОГЕНЫ И ИХ СОЕДИНЕНИЯ  Состав краски
Состав краски Презентация по Химии "Бензини" - скачать смотреть бесплатно
Презентация по Химии "Бензини" - скачать смотреть бесплатно Аттестационная работа. Программа внеурочной деятельности по химии “Занимательная химия”. (8 класс)
Аттестационная работа. Программа внеурочной деятельности по химии “Занимательная химия”. (8 класс) Алкины Физические и химические свойства. Получения. Реакции. Использование человеком. Тесты, Задачи, Вопросы.
Алкины Физические и химические свойства. Получения. Реакции. Использование человеком. Тесты, Задачи, Вопросы.  Топливо и топливосжигающие устройства. Горение топлива
Топливо и топливосжигающие устройства. Горение топлива Сократительная функция всех типов мышц
Сократительная функция всех типов мышц Растворы. Лекция 7
Растворы. Лекция 7 Задачи Спирты. Альдегиды
Задачи Спирты. Альдегиды Древняя античная химия
Древняя античная химия Химические свойства воды (домашнее задание)
Химические свойства воды (домашнее задание)