Содержание
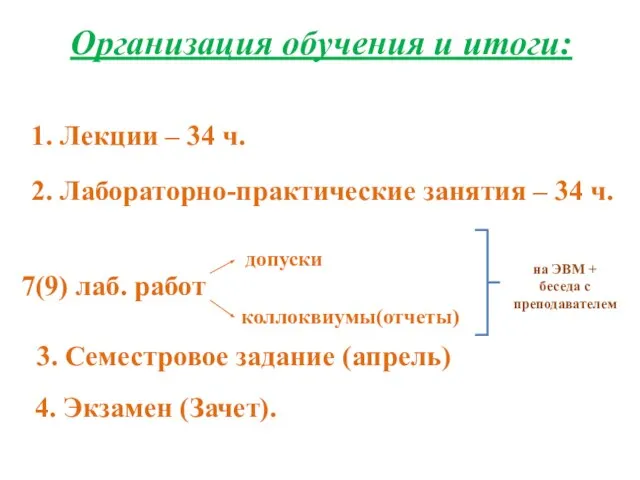
- 2. Организация обучения и итоги: допуски 3. Семестровое задание (апрель) 2. Лабораторно-практические занятия – 34 ч. 1.
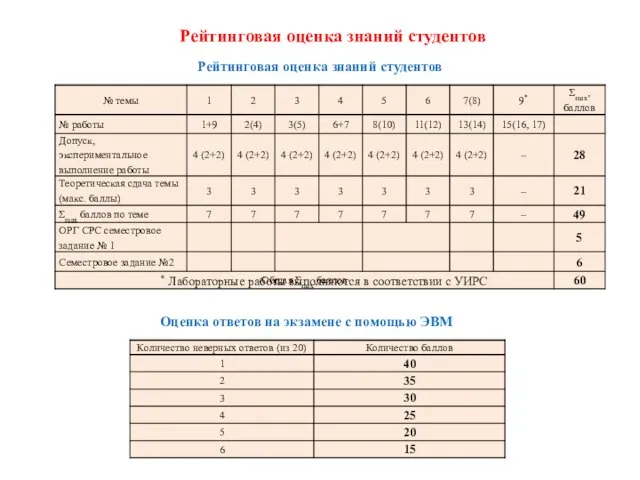
- 3. * Лабораторные работы выполняются в соответствии с УИРС Рейтинговая оценка знаний студентов Оценка ответов на экзамене
- 4. Вопросы к экзамену по дисциплине «Поверхностные явлении и дисперсные системы» (коллоидная химия) 1. Понятие о дисперсности,
- 5. 13. Избирательное смачивание и шероховатость поверхности. 14. Адгезия и когезия. Уравнение Юнга-Дюпре. 15. Модификация поверхности поверхностно-активными
- 6. 30. Связь поверхностной энергии с электрическим зарядом. Уравнение Липпмана. 31. Теории строения ДЭС. Теории Гельмгольца, Гуи-Чампена,
- 7. Малышева, Ж. Н. Теоретическое и практическое руководство по дисциплине "Поверхностные явления и дисперсные системы": учеб. пособие.
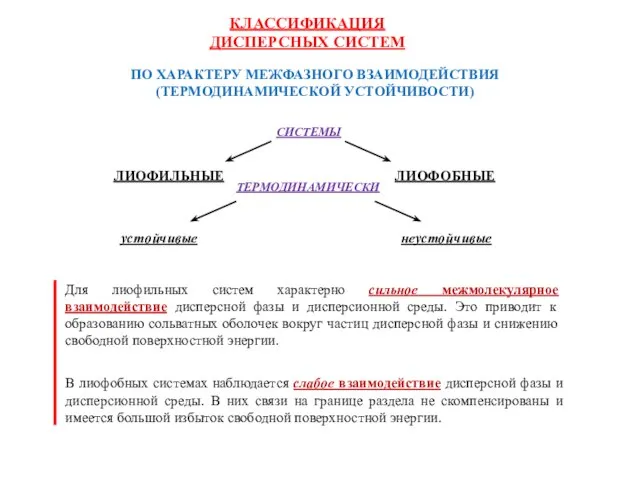
- 8. "Поверхностные явления и дисперсные системы" − это современное название традиционной дисциплины, известной как Коллоидная химия (описательная
- 9. Пётр Александрович Ребиндер
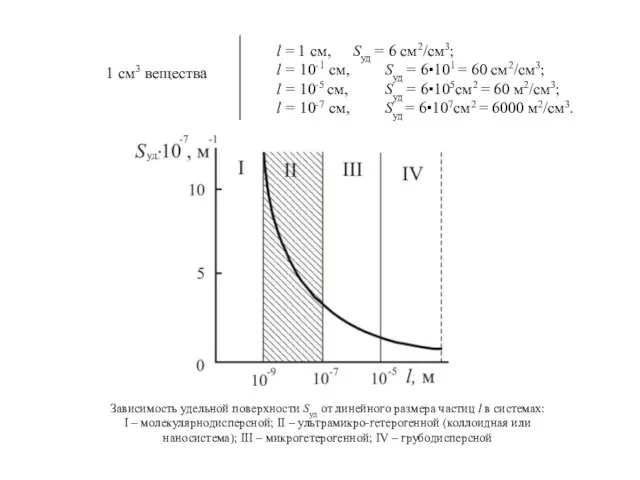
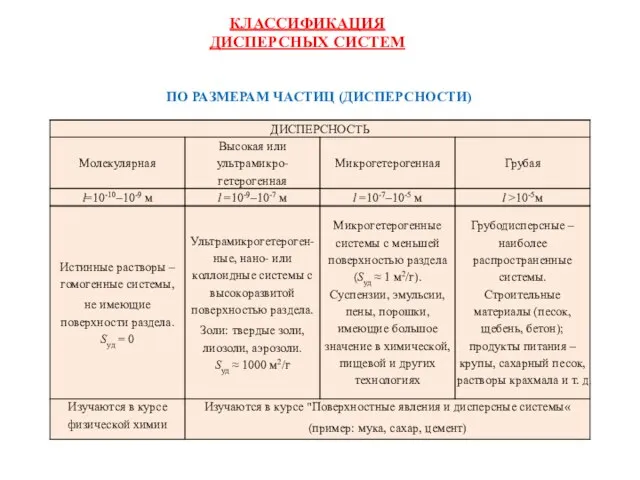
- 10. Понятие о дисперсности, дисперсных системах и поверхностных явлениях D - Дисперсность (раздробленность) вещества; l - линейный
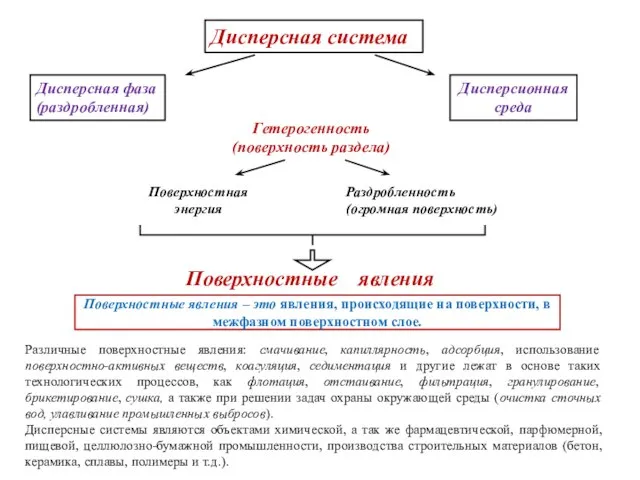
- 12. Дисперсная система Дисперсная фаза (раздробленная) Дисперсионная среда Поверхностные явления – это явления, происходящие на поверхности, в
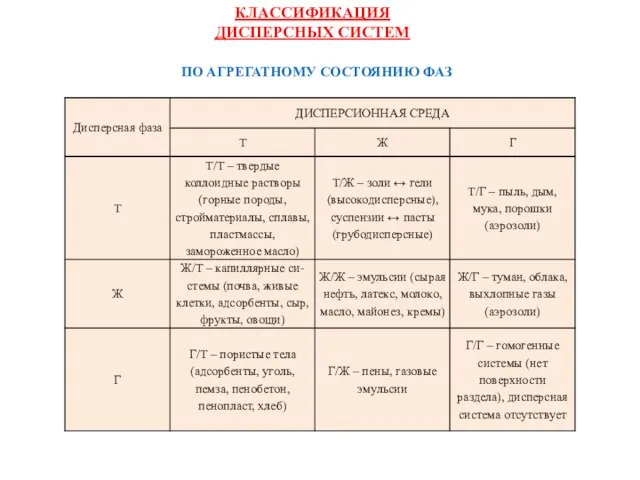
- 14. ПО АГРЕГАТНОМУ СОСТОЯНИЮ ФАЗ КЛАССИФИКАЦИЯ ДИСПЕРСНЫХ СИСТЕМ
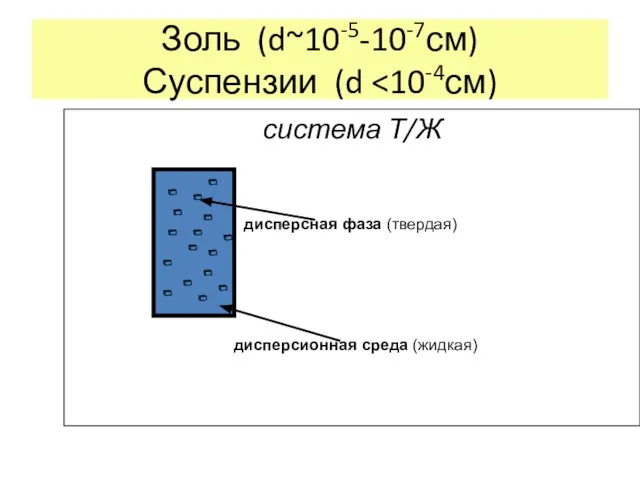
- 17. Золь (d~10-5-10-7см) Суспензии (d система Т/Ж дисперсная фаза (твердая) дисперсионная среда (жидкая)
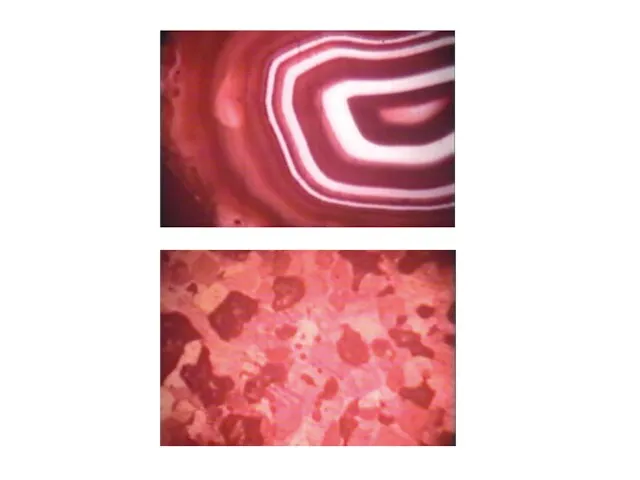
- 18. Золь золота
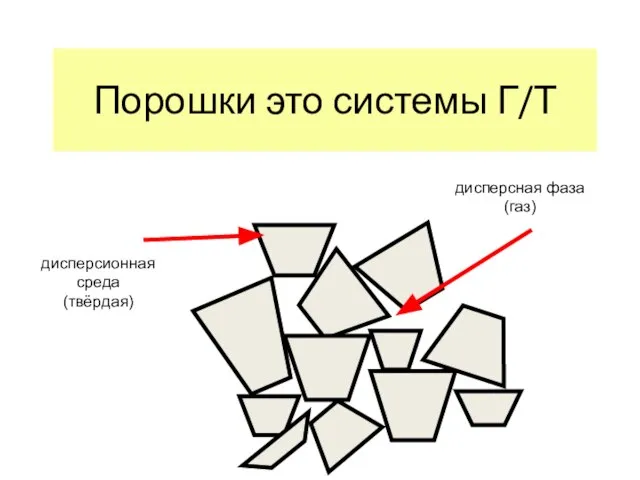
- 19. Порошки это системы Г/Т дисперсионная среда (твёрдая) дисперсная фаза (газ)
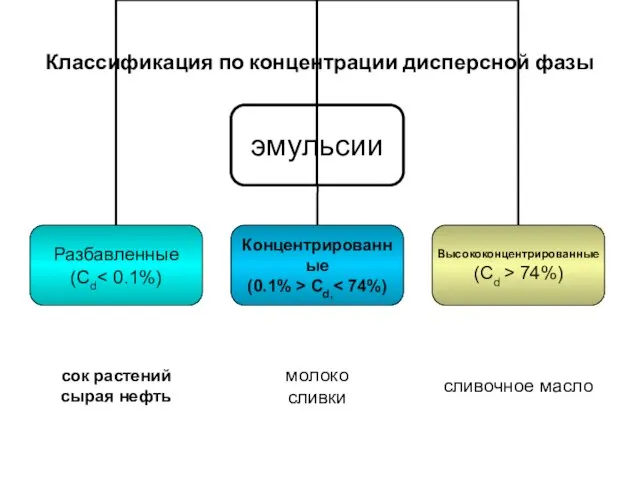
- 20. Классификация по концентрации дисперсной фазы
- 21. Нефть – разбавленная обратная эмульсия (В/М) Нефть-
- 22. ХАРАКТЕРНЫЕ ОСОБЕННОСТИ ДИСПЕРСНЫХ СИСТЕМ Гетерогенность это основная или качественная характеристика дисперсных систем Дисперсность дополнительная или количественная
- 24. Шар 1) Трехмерные (частицы) где l – длина ребра куба; N – число частиц в системе.
- 25. 2) Двухмерные (поры, капилляры) 3) Одномерные (пленки, мембраны) где r – радиус, l – диаметр, L
- 26. Зависимость удельной поверхности Syд от линейного размера частиц l в системах: I – молекулярнодисперсной; II –
- 28. ПО РАЗМЕРАМ ЧАСТИЦ (ДИСПЕРСНОСТИ) КЛАССИФИКАЦИЯ ДИСПЕРСНЫХ СИСТЕМ
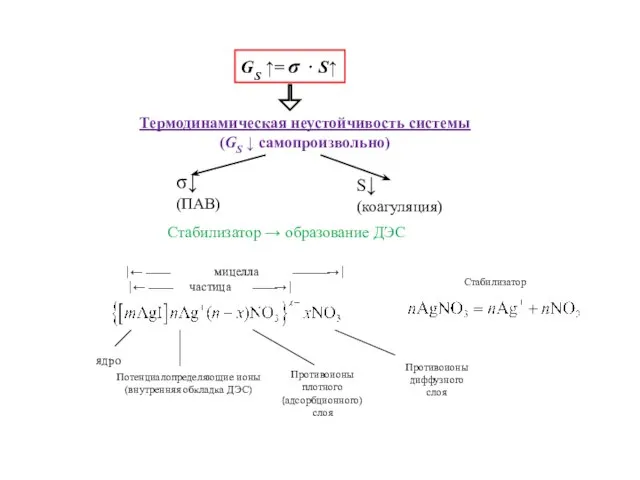
- 29. Гетерогенность (мера - удельная поверхностная энергия GSуд ) Общая поверхностная энергия GS : GSуд = σ
- 32. GS ↑= σ ⋅ S↑ Термодинамическая неустойчивость системы (GS ↓ самопроизвольно) Стабилизатор → образование ДЭС Стабилизатор
- 36. ПО СООТНОШЕНИЮ РАЗМЕРОВ ЧАСТИЦ ДИСПЕРСНОЙ ФАЗЫ СИСТЕМЫ моно- поли- КЛАССИФИКАЦИЯ ДИСПЕРСНЫХ СИСТЕМ
- 37. ПО ХАРАКТЕРУ МЕЖФАЗНОГО ВЗАИМОДЕЙСТВИЯ (ТЕРМОДИНАМИЧЕСКОЙ УСТОЙЧИВОСТИ) КЛАССИФИКАЦИЯ ДИСПЕРСНЫХ СИСТЕМ
- 39. Скачать презентацию























 Скорость реакции и температура. (Лекция 10)
Скорость реакции и температура. (Лекция 10) Химия биогенных элементов
Химия биогенных элементов Химические элементы в быту
Химические элементы в быту Углеводороды. Структура и функции биолекул
Углеводороды. Структура и функции биолекул Полисилоксаны. Классификация полимеров
Полисилоксаны. Классификация полимеров Методы познания химии
Методы познания химии Высокомолекулярные соединения (ВМС) или полимеры
Высокомолекулярные соединения (ВМС) или полимеры Используя оксид ртути (II) напишите уравнения реакций при которых возможны следующие превращения: Используя оксид ртути (II) напишит
Используя оксид ртути (II) напишите уравнения реакций при которых возможны следующие превращения: Используя оксид ртути (II) напишит Ювелирное дело. Империя самоцветов
Ювелирное дело. Империя самоцветов Алкандар. (қаныққан көмірсутектер. Парафиндер.)
Алкандар. (қаныққан көмірсутектер. Парафиндер.) Определение подлинности лекарственных веществ
Определение подлинности лекарственных веществ Пестициды. Применение пестицидов
Пестициды. Применение пестицидов Строение твердого вещества
Строение твердого вещества Золото. Свойство золота
Золото. Свойство золота Сверхразветвленные полимеры: типы, получение, применение
Сверхразветвленные полимеры: типы, получение, применение Арены. Бензол
Арены. Бензол В гостях у Хозяйки Медной горы. Покровская сельская библиотека
В гостях у Хозяйки Медной горы. Покровская сельская библиотека Рождающий воду
Рождающий воду Химическая связь
Химическая связь Газообразные вещества
Газообразные вещества Ртуть. Нахождение в природе. Применение
Ртуть. Нахождение в природе. Применение Изомерия комплексных соединений
Изомерия комплексных соединений Жесткость воды и способы ее устранения
Жесткость воды и способы ее устранения Вспомогательные вещества. Флюсы и их применение. Кислоты, соли, щёлочи применяемые в ювелирном деле. (Лекция 3)
Вспомогательные вещества. Флюсы и их применение. Кислоты, соли, щёлочи применяемые в ювелирном деле. (Лекция 3) Производство синтетических моющих средств
Производство синтетических моющих средств Поверхностно-активные вещества (ПАВ). Классификация ПАВ по степени влияния на окружающую среду
Поверхностно-активные вещества (ПАВ). Классификация ПАВ по степени влияния на окружающую среду Твердофазное восстановление металлов и образование карбидов из хромовых концентратов Аганозерского месторождения
Твердофазное восстановление металлов и образование карбидов из хромовых концентратов Аганозерского месторождения Простейшие операции с веществом (химический практикум)
Простейшие операции с веществом (химический практикум)