Содержание
- 2. Изомерия комплексных соединений Изомерия – явление существования соединений (изомеров), одинаковых по составу и мол. массе, но
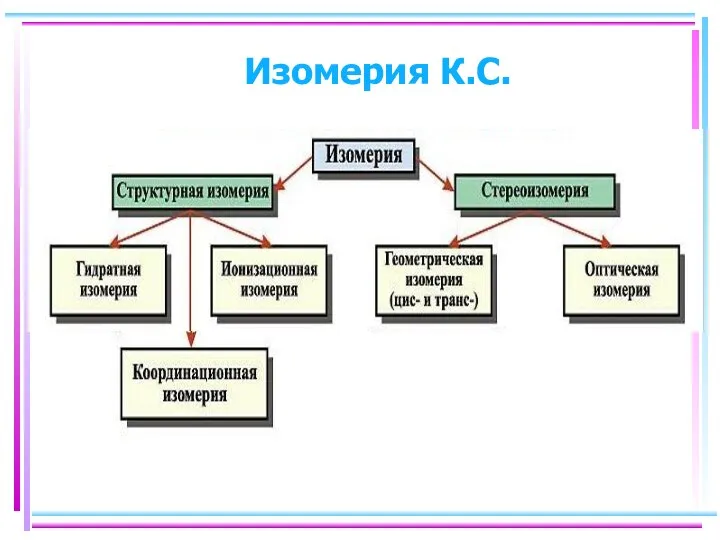
- 3. Изомерия К.С.
- 4. Изомерия лигандов Связевая —NO2– и —ONO– нитро- нитрито- [Co(NH3)5NO2]2+ (желто-коричн.р-р) [Co(NH3)5ONO]2+ (розов.р-р) —NCS– и —SCN– тиоцианато-N
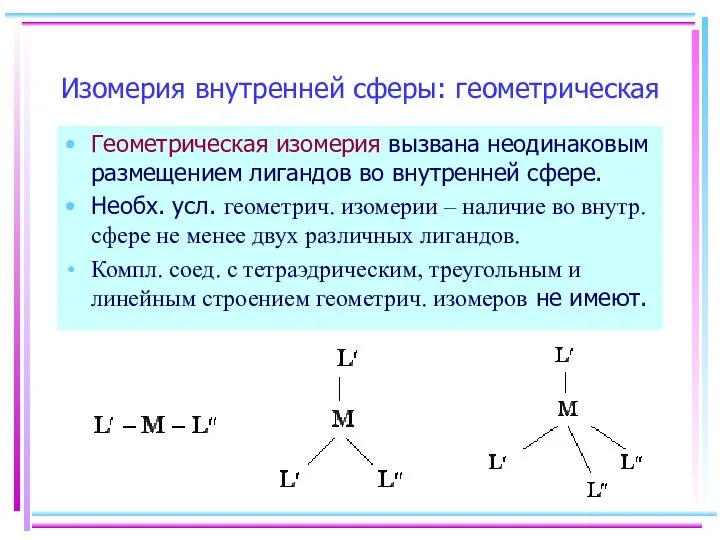
- 5. Изомерия внутренней сферы: геометрическая Геометрическая изомерия вызвана неодинаковым размещением лигандов во внутренней сфере. Необх. усл. геометрич.
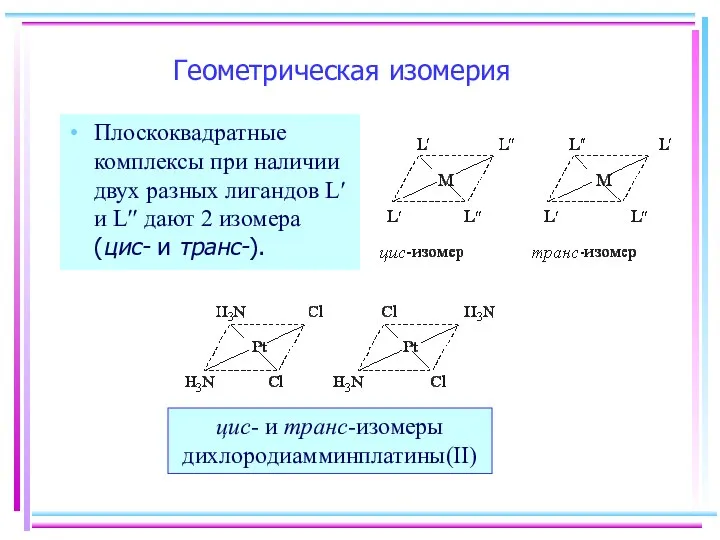
- 6. Геометрическая изомерия Плоскоквадратные комплексы при наличии двух разных лигандов L′ и L′′ дают 2 изомера (цис-
- 7. Геометрическая изомерия [ML′5L′′]: изомеров нет цис- и транс-изомеры дигидроксотетраамминкобальта(II)
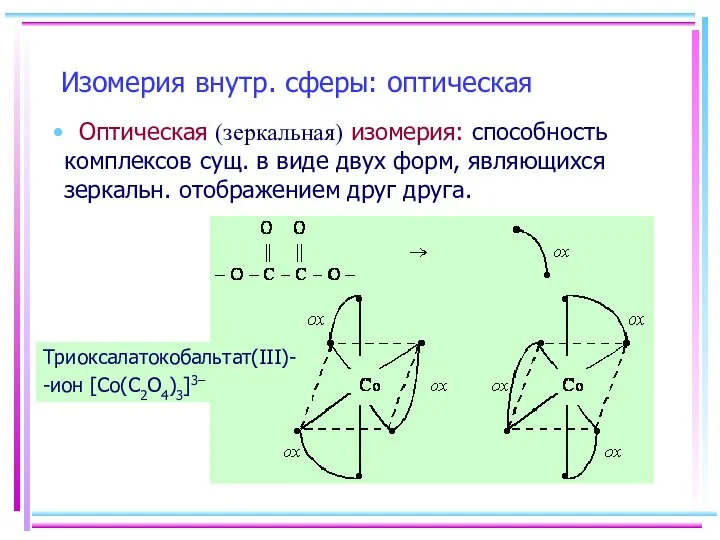
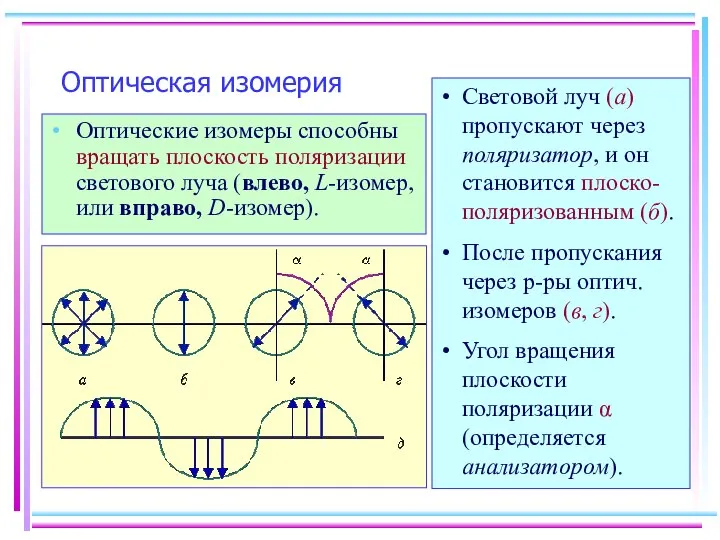
- 8. Изомерия внутр. сферы: оптическая Оптическая (зеркальная) изомерия: способность комплексов сущ. в виде двух форм, являющихся зеркальн.
- 9. Оптическая изомерия Оптические изомеры способны вращать плоскость поляризации светового луча (влево, L-изомер, или вправо, D-изомер). Световой
- 10. Ионизационная изомерия КС Лиганды во внутренней и внешней сфере меняются местами. [Co(NH3)5Cl]CN –цианид хлоропентаамминкобальта (II) [Co(NH3)5СN]Cl
- 11. Частный случай ионизационной изомерии – гидратная изомерия CrCl3.6H2O – три изомера
- 12. - обмен лигандами между комплексными анионами и катионом Координационная изомерия
- 13. Квантовомеханические теории строения комплексных соединений
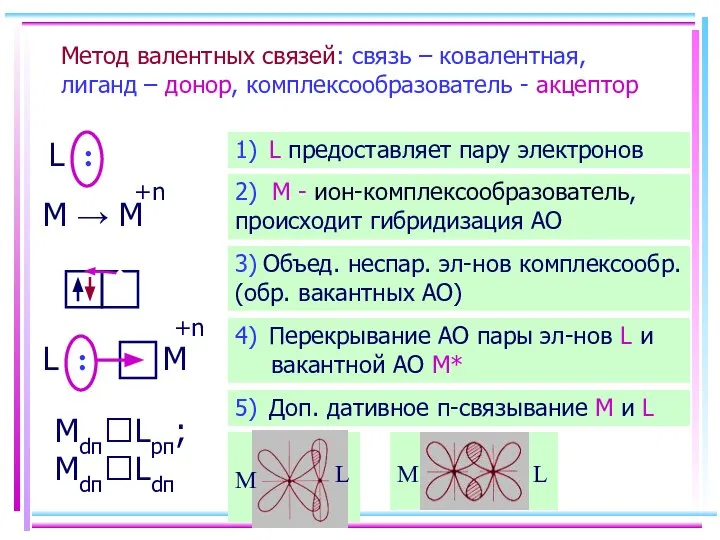
- 14. Квантовомеханические теории строения комплексных соединений Для объяснения строения комплексных соединений наиболее широко применяются теория валентных связей
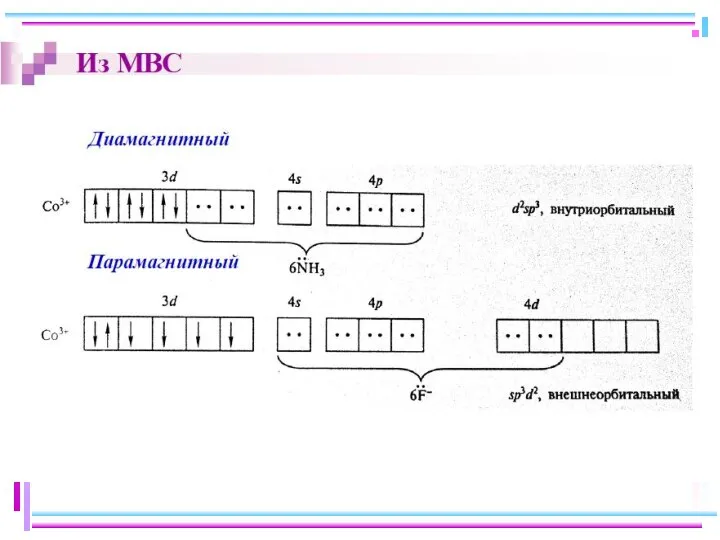
- 15. Метод валентных связей: связь – ковалентная, лиганд – донор, комплексообразователь - акцептор L : M →
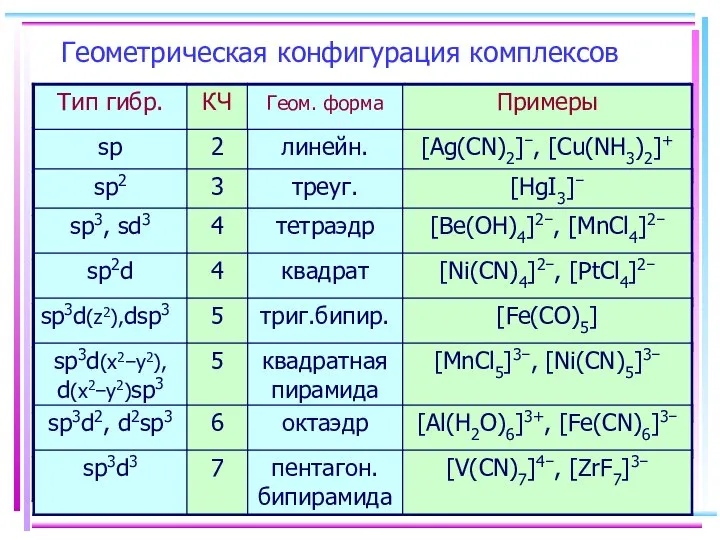
- 16. Геометрическая конфигурация комплексов
- 17. Zn0:4s23d104p0 Zn2+:4s03d104p0 3d 4s 4p Zn2+: •• •• •• •• [ Zn (NH3)4]2+ sp3
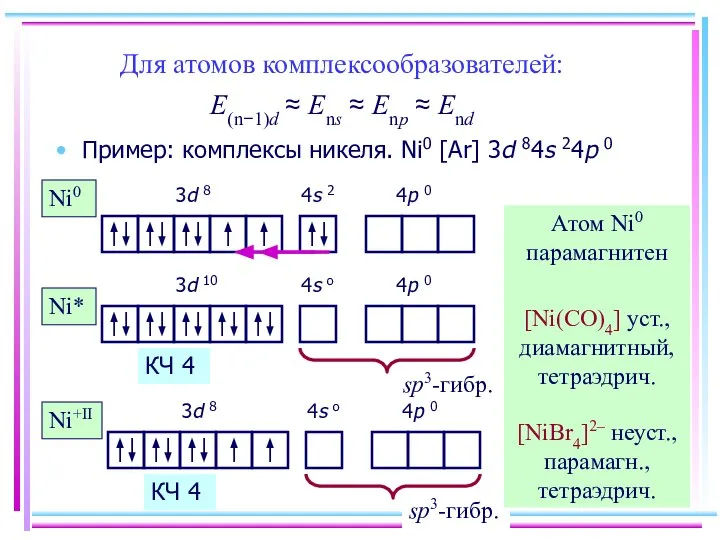
- 18. Для атомов комплексообразователей: E(n−1)d ≈ Ens ≈ Enp ≈ End Пример: комплексы никеля. Ni0 [Ar] 3d
- 19. Ni+II [Ni(CN)4]2– уст. (низкоспин.), диамагн., внутриорбитальный КЧ 4 [Ni(CN)5]3– уст. (низкоспин.), , диамагн., КЧ 5 [Ni(H2O)6]2+,
- 20. Fe+II [FeF6]4– парамагн., высокоспиновый внешнеорбитальный , КЧ 6 Fe+II [Fe(CN)6]4– диамагн., низкоспиновый, внутриорбитальный КЧ 6
- 21. [Fe(CN)6]3– Атом Fe0: 3d64S2 □□□□□ □ □□□ □□□□□ □ □□□ ↑ ↑↓ ↑ ↑ ↑ ↑↓
- 22. Пространственное строение [Fe(CN)6]3- □□□□□ □ □□□ 3d 4S 4p ↑↓ ↑↓ ↑ •• •• •• ••
- 23. 3d 4s 4p Cr3+: •• •• •• •• [Cr(H2O)6 ]3+ •• •• d2sp3 Cr0: 3d54s1 Cr3+
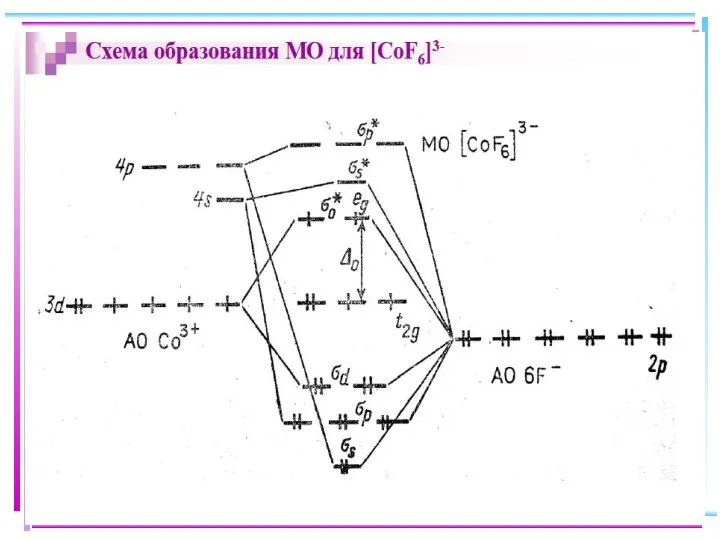
- 24. Основные положения теории кристаллического поля (поля лигандов) Связь комплексообразователя (центр. атома) M с лигандами L считается
- 25. В случае [ML6]n±,0 : октаэдрическое поле лигандов Поле слабо влияет (энергия падает) в случае АО d(xy),
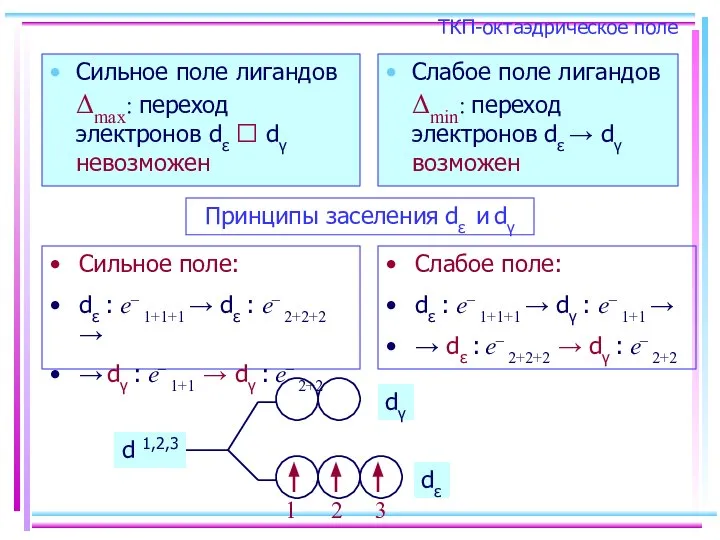
- 26. ТКП-октаэдрическое поле Сильное поле лигандов Δmax: переход электронов dε ⭲ dγ невозможен Слабое поле лигандов Δmin:
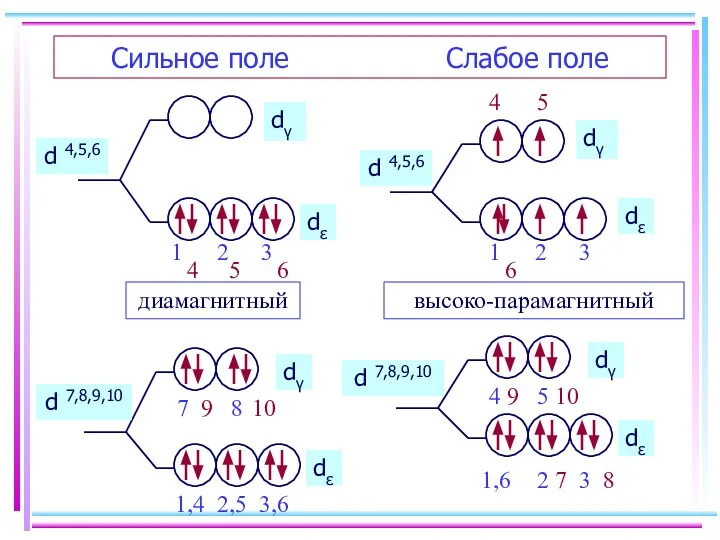
- 27. Сильное поле Слабое поле d 4,5,6 d 4,5,6 диамагнитный высоко-парамагнитный d 7,8,9,10 d 7,8,9,10
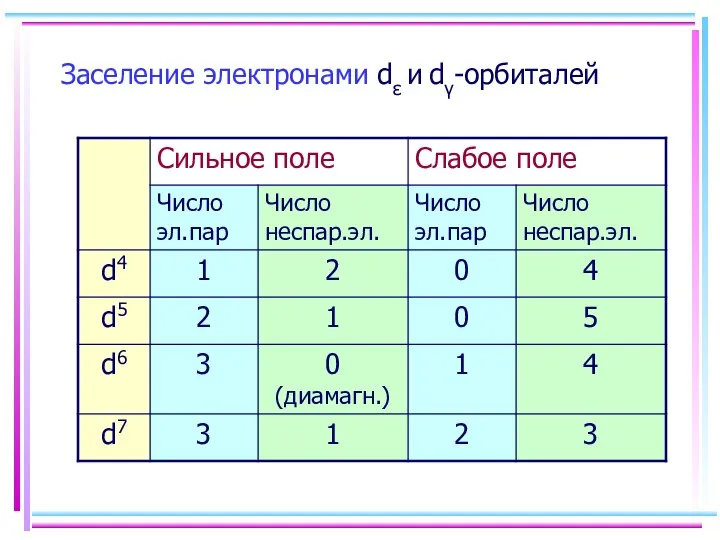
- 28. Заселение электронами dε и dγ-орбиталей
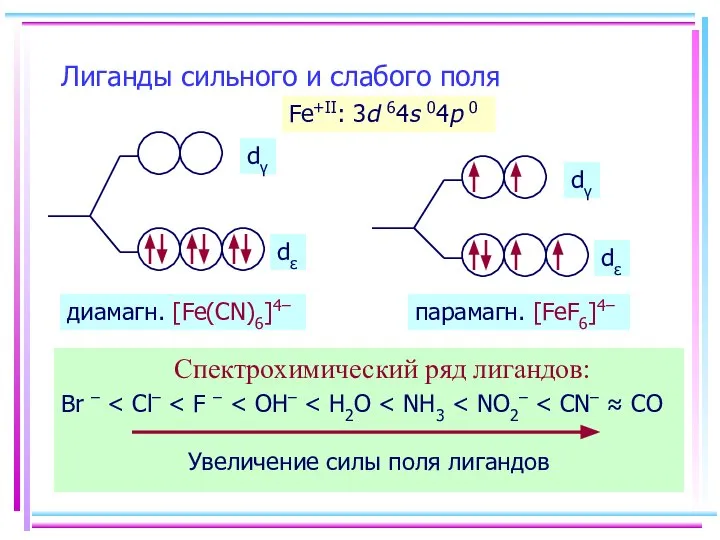
- 29. Лиганды сильного и слабого поля Спектрохимический ряд лигандов: Br – Fe+II: 3d 64s 04p 0 диамагн.
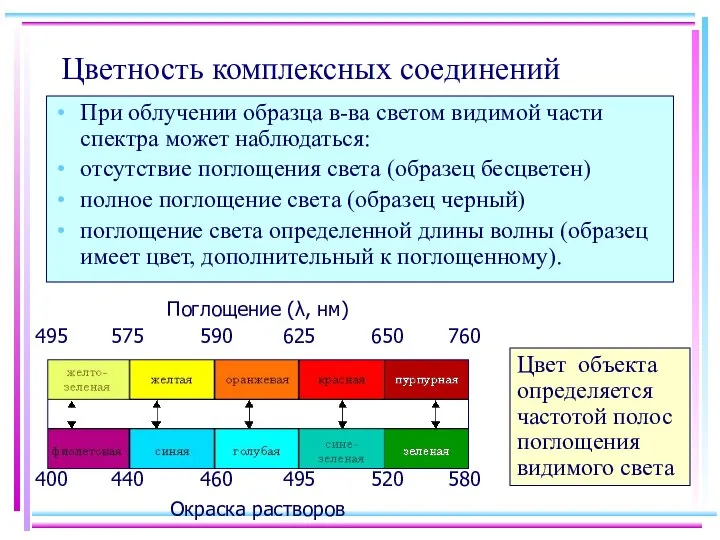
- 30. Цветность комплексных соединений При облучении образца в-ва светом видимой части спектра может наблюдаться: отсутствие поглощения света
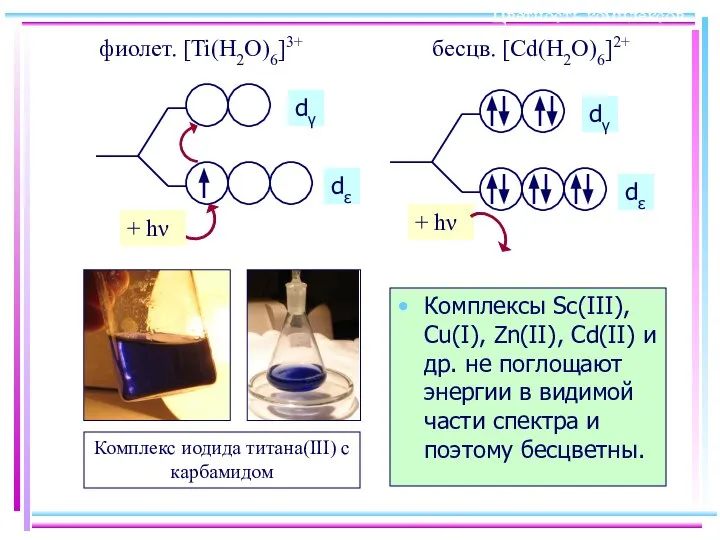
- 31. Цветность комплексов Комплексы Sc(III), Cu(I), Zn(II), Cd(II) и др. не поглощают энергии в видимой части спектра
- 32. Параметр расщепления Δ 1 см–1 соответствует ок. 12 Дж/моль Δ : 60 ÷ 420 кДж/моль или
- 40. Скачать презентацию

![Изомерия лигандов Связевая —NO2– и —ONO– нитро- нитрито- [Co(NH3)5NO2]2+ (желто-коричн.р-р) [Co(NH3)5ONO]2+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404738/slide-3.jpg)
![Геометрическая изомерия [ML′5L′′]: изомеров нет цис- и транс-изомеры дигидроксотетраамминкобальта(II)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404738/slide-6.jpg)





![Zn0:4s23d104p0 Zn2+:4s03d104p0 3d 4s 4p Zn2+: •• •• •• •• [ Zn (NH3)4]2+ sp3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404738/slide-16.jpg)
![Ni+II [Ni(CN)4]2– уст. (низкоспин.), диамагн., внутриорбитальный КЧ 4 [Ni(CN)5]3– уст. (низкоспин.),](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404738/slide-18.jpg)
![Fe+II [FeF6]4– парамагн., высокоспиновый внешнеорбитальный , КЧ 6 Fe+II [Fe(CN)6]4– диамагн., низкоспиновый, внутриорбитальный КЧ 6](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404738/slide-19.jpg)
![[Fe(CN)6]3– Атом Fe0: 3d64S2 □□□□□ □ □□□ □□□□□ □ □□□ ↑](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404738/slide-20.jpg)
![Пространственное строение [Fe(CN)6]3- □□□□□ □ □□□ 3d 4S 4p ↑↓ ↑↓](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404738/slide-21.jpg)
![3d 4s 4p Cr3+: •• •• •• •• [Cr(H2O)6 ]3+ ••](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404738/slide-22.jpg)

![В случае [ML6]n±,0 : октаэдрическое поле лигандов Поле слабо влияет (энергия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404738/slide-24.jpg)



 Соли. Состав и номенклатура
Соли. Состав и номенклатура Аттестационная работа. Проектно - исследовательская технология, как способ формирования УУД по химии
Аттестационная работа. Проектно - исследовательская технология, как способ формирования УУД по химии студентка группы ГЭ-1-07 факультета ЭиУ Малышева Е.И. «Биомасса – альтернативный источник энергии» студентка группы ГЭ-1-07 фак
студентка группы ГЭ-1-07 факультета ЭиУ Малышева Е.И. «Биомасса – альтернативный источник энергии» студентка группы ГЭ-1-07 фак Углеводы
Углеводы Простые вещества металлы
Простые вещества металлы Уроки зельеварения. Задача 6
Уроки зельеварения. Задача 6 Матчворк Підготувала учениця 11-А класу Шведюк Людмила
Матчворк Підготувала учениця 11-А класу Шведюк Людмила  Уран. Получение урана
Уран. Получение урана Азот
Азот Сера
Сера В чем секрет любви к мороженому ?
В чем секрет любви к мороженому ? Литье под давлением реактопластов
Литье под давлением реактопластов Олигомеризация олефинов
Олигомеризация олефинов Кристаллография. Точечные группы симметрии, принцип их вывода с помощью понятия о группах. Формы кристаллов низшей категории
Кристаллография. Точечные группы симметрии, принцип их вывода с помощью понятия о группах. Формы кристаллов низшей категории Теоретические основы технологии неорганических веществ. (Тема 2)
Теоретические основы технологии неорганических веществ. (Тема 2) Химия биогенных элементов p -блока
Химия биогенных элементов p -блока Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды Азотная кислота – HNO3 – «взрывоопасная царская особа» МБОУ «Рождественская средняя общеобразовательная школа» Собинско
Азотная кислота – HNO3 – «взрывоопасная царская особа» МБОУ «Рождественская средняя общеобразовательная школа» Собинско Высокомолекулярные вещества
Высокомолекулярные вещества Фосфор и его соединения
Фосфор и его соединения Арилалкиламины, гидроксифенилалкиламины и их производные
Арилалкиламины, гидроксифенилалкиламины и их производные Амфотерні гідроксиди
Амфотерні гідроксиди Презентация по Химии "Природні І синтетичні Органічні речовини" - скачать смотреть бесплатно
Презентация по Химии "Природні І синтетичні Органічні речовини" - скачать смотреть бесплатно Эндогенная серия. Карбонатитовая группа
Эндогенная серия. Карбонатитовая группа Поверхностные явления
Поверхностные явления Коррозия металлов
Коррозия металлов Химиялық, принципиалдық және технологиялық сызбанұсқалар. Технологиялқ процестерді ұйымдастыру принциптері
Химиялық, принципиалдық және технологиялық сызбанұсқалар. Технологиялқ процестерді ұйымдастыру принциптері Реактор получения элементарной серы
Реактор получения элементарной серы