Содержание
- 2. Поверхностные явления – те эффекты и особенности поведения веществ, которые наблюдаются на поверхности раздела фаз. К
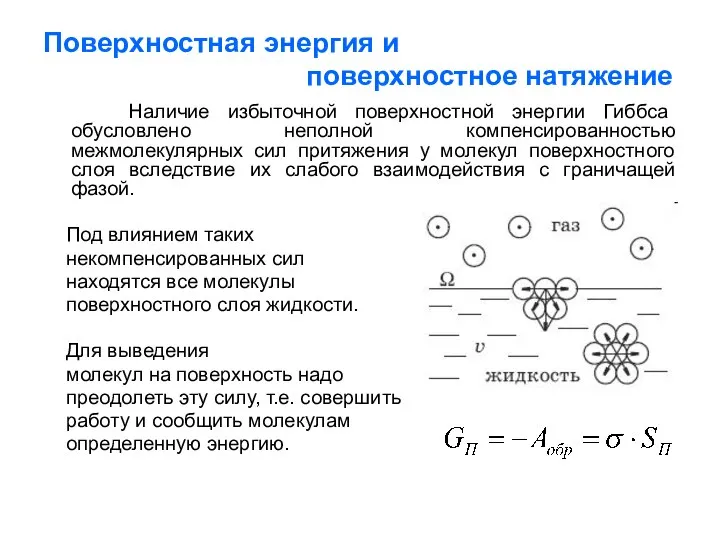
- 3. Поверхностная энергия и поверхностное натяжение Наличие избыточной поверхностной энергии Гиббса обусловлено неполной компенсированностью межмолекулярных сил притяжения
- 4. Физический смысл поверхностного натяжения Энергетическая трактовка: поверхностное натяжение равно работе, затраченной на образование единицы поверхности: ,
- 5. Благодаря поверхностному натяжению капля жидкости в свободном падении принимает сферическую форму.
- 6. Факторы, влияющие на поверхностное натяжение 1) Температура С увеличением температуры σ уменьшается. Температура, при которой поверхностное
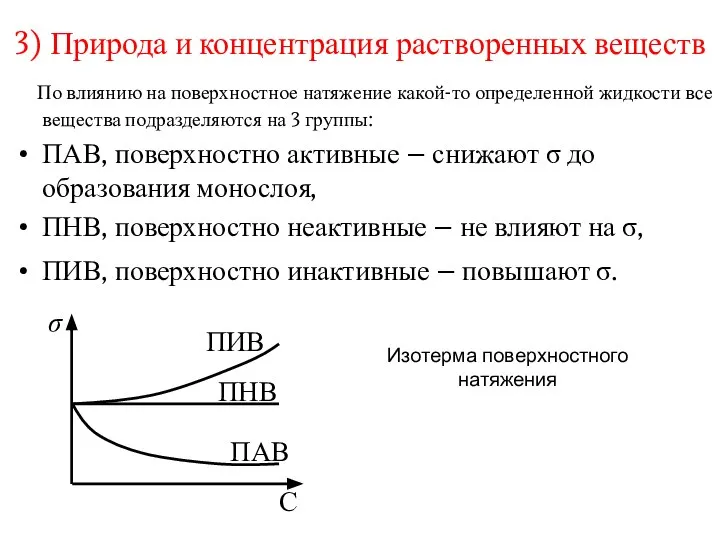
- 7. 3) Природа и концентрация растворенных веществ По влиянию на поверхностное натяжение какой-то определенной жидкости все вещества
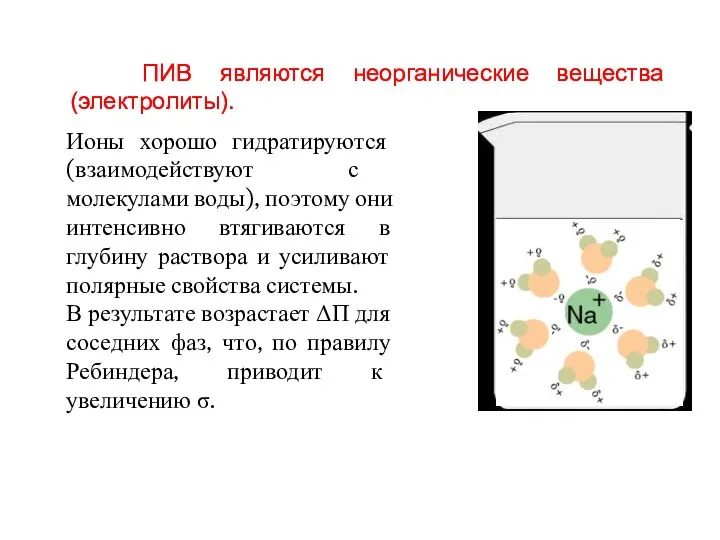
- 8. ПИВ являются неорганические вещества (электролиты). Ионы хорошо гидратируются (взаимодействуют с молекулами воды), поэтому они интенсивно втягиваются
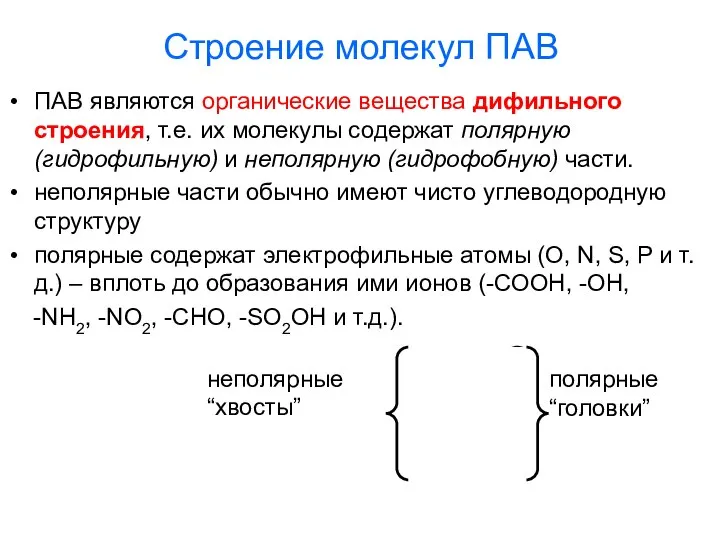
- 9. Строение молекул ПАВ ПАВ являются органические вещества дифильного строения, т.е. их молекулы содержат полярную (гидрофильную) и
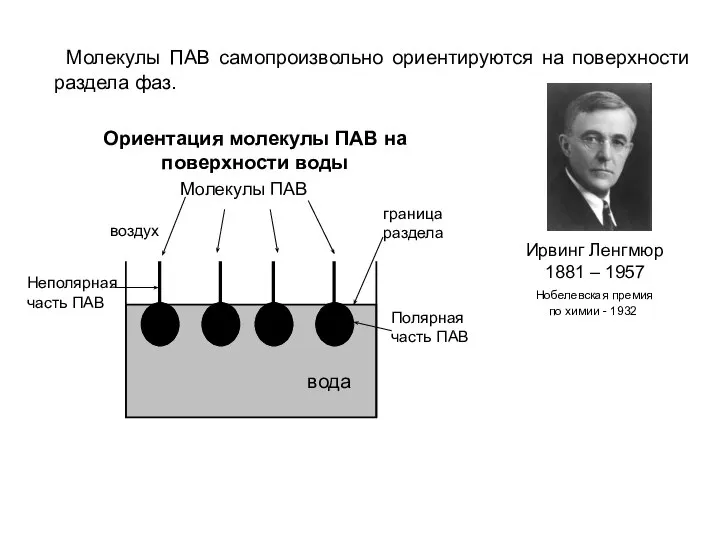
- 10. Молекулы ПАВ самопроизвольно ориентируются на поверхности раздела фаз. Ирвинг Ленгмюр 1881 – 1957 Нобелевская премия по
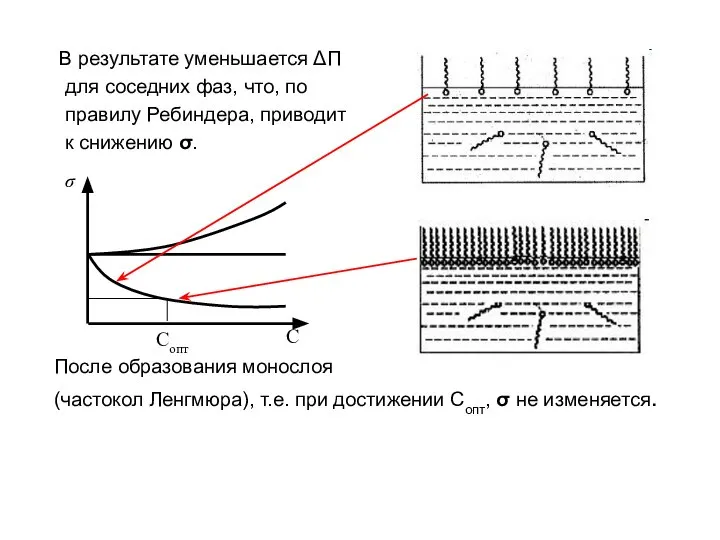
- 11. В результате уменьшается ΔП для соседних фаз, что, по правилу Ребиндера, приводит к снижению σ. После
- 13. Поверхностная активность Количественной мерой способности ПАВ понижать поверхностное натяжение на границе раздела фаз служит поверхностная активность
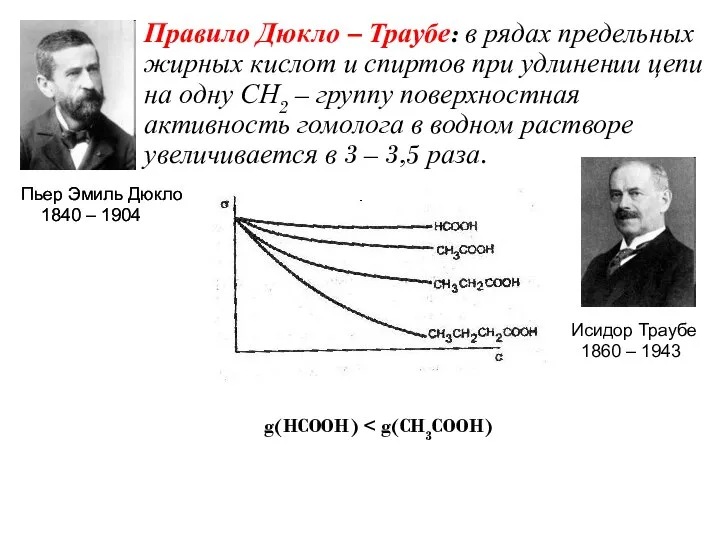
- 14. Правило Дюкло – Траубе: в рядах предельных жирных кислот и спиртов при удлинении цепи на одну
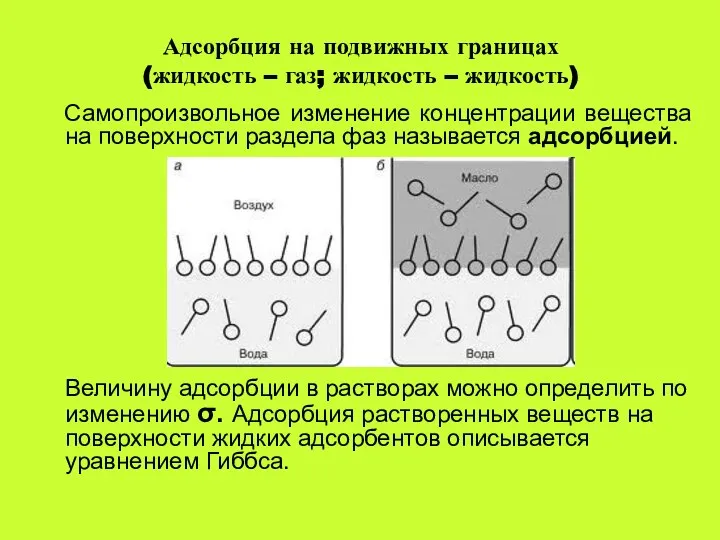
- 15. Адсорбция на подвижных границах (жидкость – газ; жидкость – жидкость) Самопроизвольное изменение концентрации вещества на поверхности
- 16. Изотерма адсорбции Гиббса Уравнение, описывающее зависимость между адсорбцией и концентрацией вещества называется изотермой адсорбции. Уравнение адсорбции
- 17. Адсорбция на неподвижных границах (твердое тело – газ; твердое тело – раствор) Причиной адсорбции на твердых
- 18. Физическая адсорбция (ФАд) возникает за счет ван-дер-ваальсовых взаимодействий и происходит на активных центрах (во впадинах поверхности).
- 19. Твердое тело, на котором происходит адсорбция, называют адсорбентом; Адсорбированное вещество, находящееся на поверхности или в объеме
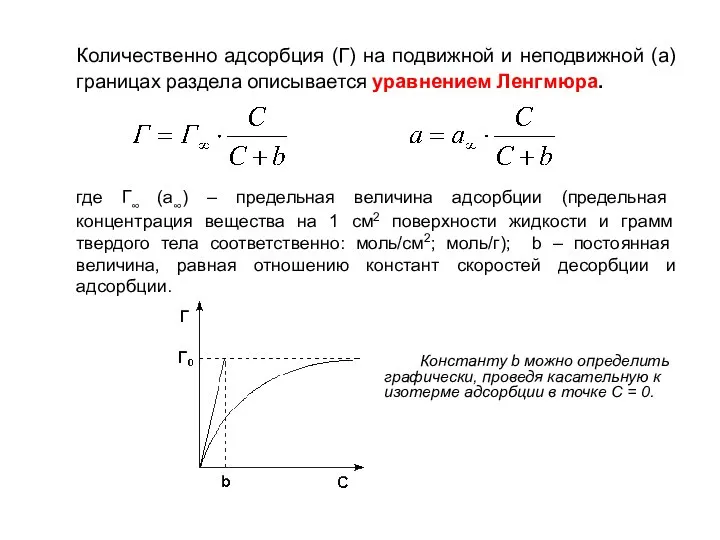
- 20. Количественно адсорбция (Г) на подвижной и неподвижной (а) границах раздела описывается уравнением Ленгмюра. где Г∞ (а∞)
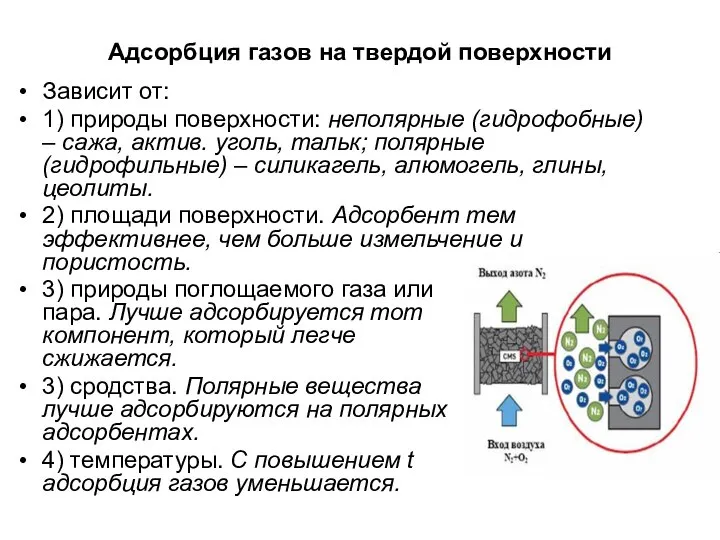
- 21. Адсорбция газов на твердой поверхности Зависит от: 1) природы поверхности: неполярные (гидрофобные) – сажа, актив. уголь,
- 22. Молекулярная адсорбция на границе твердое тело – раствор Отличие от адсорбции газов заключается в конкуренции между
- 23. 5) природы поглощаемого вещества (адсорбата): а) Правило Шилова: чем больше растворимость вещества в растворителе, тем хуже
- 24. Адсорбция ионов из растворов в зависимости от природы адсорбента подразделяется на ионную адсорбцию и ионнообменную адсорбцию
- 25. Ионная адсорбция По сравнению с молекулярной адсорбцией более сложный процесс, т.к. в растворе присутствует уже 3
- 26. Зависит от: 1) природы адсорбента. Чем более полярный адсорбент, тем лучше адсорбция ионов. 2) природы иона:
- 27. Избирательная адсорбция ионов подчиняется правилу Панета – Фаянса Например: на AgI могут адсорбироваться Ag+ и I-,
- 28. Ионообменная адсорбция Ионообменная адсорбция – это процесс, при котором твердый адсорбент обменивает свои ионы на ионы
- 29. Иониты подразделяют на катиониты, анионита и амфотерные иониты Катиониты (катионообменные сорбенты) – представляют собой нерастворимые многоосновные
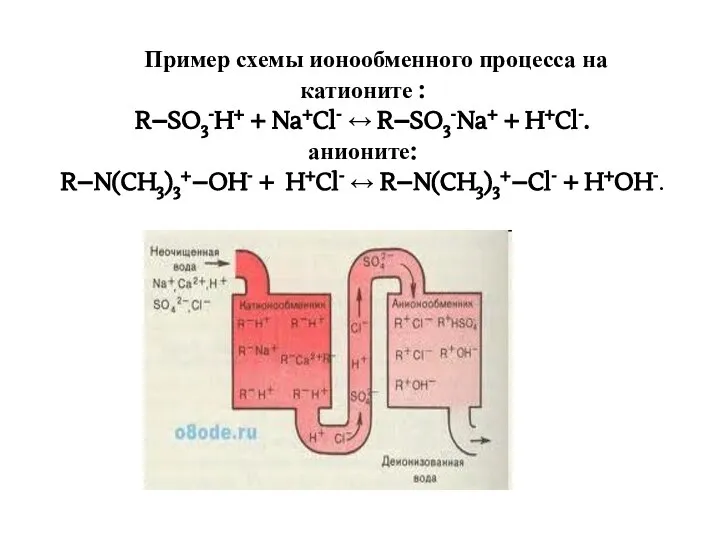
- 30. Пример схемы ионообменного процесса на катионите : R–SO3-H+ + Na+Cl- ↔ R–SO3-Na+ + H+Cl-. анионите: R–N(CH3)3+–OH-
- 32. Скачать презентацию

















 Алюміній оксид Al2O3
Алюміній оксид Al2O3  Гетероциклические соединения
Гетероциклические соединения Красители: натуральные или искусственные?
Красители: натуральные или искусственные? Строение и функция белков
Строение и функция белков Эндоскопические методы гемостаза
Эндоскопические методы гемостаза Азолы. Гетероциклы с двумя гетероатомами
Азолы. Гетероциклы с двумя гетероатомами Предельные углеводороды ( по химии для учащихся 9 класса)
Предельные углеводороды ( по химии для учащихся 9 класса) Электрохимические методы анализа. Лекция 3
Электрохимические методы анализа. Лекция 3 Химия в разных науках
Химия в разных науках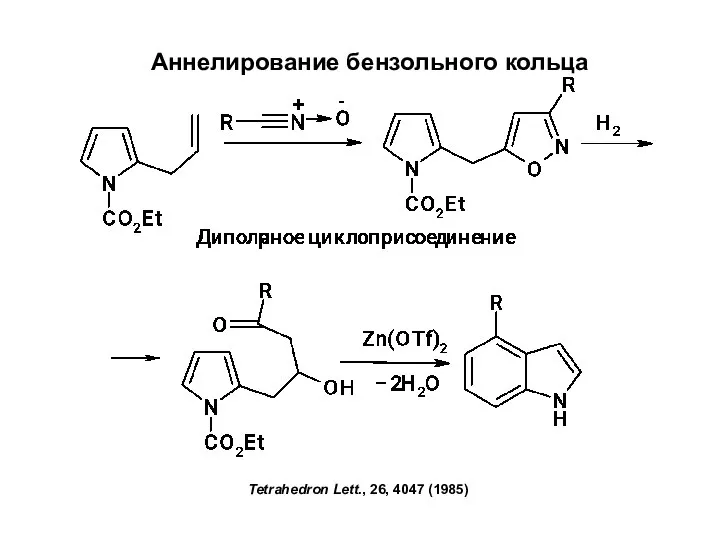 Аннелирование бензольного кольца
Аннелирование бензольного кольца Строение металлов
Строение металлов Нафта, склад, особливості залягання Підготувала учениця 2 курсу природничого класу Ніжинського ліцею ніжинської міської ради
Нафта, склад, особливості залягання Підготувала учениця 2 курсу природничого класу Ніжинського ліцею ніжинської міської ради  Жаңа дәрілерді жасау
Жаңа дәрілерді жасау Видатні вітчизняні хіміки
Видатні вітчизняні хіміки Термохимия. Типы энтальпии
Термохимия. Типы энтальпии Презентация по химии ПЕПТИДЫ и Белки
Презентация по химии ПЕПТИДЫ и Белки  ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА ПО ХИМИИ
ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА ПО ХИМИИ Методы исследования гидрохимического режима водоемов
Методы исследования гидрохимического режима водоемов Презентация по Химии "азотная кислота" - скачать смотреть бесплатно
Презентация по Химии "азотная кислота" - скачать смотреть бесплатно Программа повышения квалификации. Каталитические процессы в глубокой переработке нефти
Программа повышения квалификации. Каталитические процессы в глубокой переработке нефти Презентация по Химии "Презентация Золото" - скачать смотреть
Презентация по Химии "Презентация Золото" - скачать смотреть  Химия, 8 класс УЧИТЕЛЬ Краснова Оксана Владимировна
Химия, 8 класс УЧИТЕЛЬ Краснова Оксана Владимировна  Расчет концентрационных пределов воспламенения жидкости
Расчет концентрационных пределов воспламенения жидкости Решение экспериментальных задач по теме металлы
Решение экспериментальных задач по теме металлы Посуда, ее виды и использование. Работу выполнила Гливинская Анастасия ученица 9 класса МБОУ «СОШ №11»
Посуда, ее виды и использование. Работу выполнила Гливинская Анастасия ученица 9 класса МБОУ «СОШ №11»  Стадии и общая схема почвообразования
Стадии и общая схема почвообразования Аттестационная работа. Окраска ткани природными красителями
Аттестационная работа. Окраска ткани природными красителями Химия в содружестве с другими науками
Химия в содружестве с другими науками