Содержание
- 2. Що ми дізнаємося на сьогоднішньому уроці? Визначення карбонових кислот Класифікація Походження в природі Електронна будова Ізомерія
- 3. Карбонові кислоти - органічні сполуки, що містять одну або кілька карбоксильних груп-СООН. Карбоксильна група містить дві
- 4. 1.Залежно від числа карбоксильних груп ● одноосновні (монокарбонові) Наприклад: НСООН, С3Н7СООН ● двохосновні – щавлева ●
- 5. Багато кислот мають історично сформовані або тривіальні назви, пов'язані головним чином з джерелом їх отримання. Мурашина
- 6. Електронна будова 1. Електронна густина зсувається в бік кисню 2.Атом вуглецю здобуває позитивний заряд 3. В
- 7. Номенклатура карбонових кислот Систематичні назви кислот утворюються за назвою відповідного вуглеводню з додаванням суфікса –ова й
- 8. Ізомерія – структурна ізомерія - ізомерія кістяка у вуглеводневму радикалі (починаючи з C4). – міжкласова ізомерія,
- 9. Способи добування Мурашина кислота зустрічається в вільному стані. Вона міститься в соках кропиви, хвої, фруктах, а
- 10. Способи добування Оцтова кислота часто зустрічається в природі. Вона міститься в сечі, поті, жовчі і шкірі
- 11. Як сильний відновник в хімічній промисловості Як дезінфікуючий засіб в харчовій промисловості Для дублення шкіри в
- 12. Застосування оцтової кислоти
- 13. Фізичні властивості карбонових кислот Серед карбонових кислот немає газоподібних речовин. Нижчі члени ряду – безбарвні рідини,
- 15. Скачать презентацию












 Волокно капрон
Волокно капрон Полимеры, пластмассы и изделия из них
Полимеры, пластмассы и изделия из них Моделирование, как метод научного исследования. Ограниченный метод Хартри-Фока
Моделирование, как метод научного исследования. Ограниченный метод Хартри-Фока Электролиз: опыты к заданиям ЕГЭ
Электролиз: опыты к заданиям ЕГЭ Битумы и материалы на основе битумов
Битумы и материалы на основе битумов Камни мира. Минералы
Камни мира. Минералы Молярный объём газов
Молярный объём газов Катаболизм фенилаланина, тирозина
Катаболизм фенилаланина, тирозина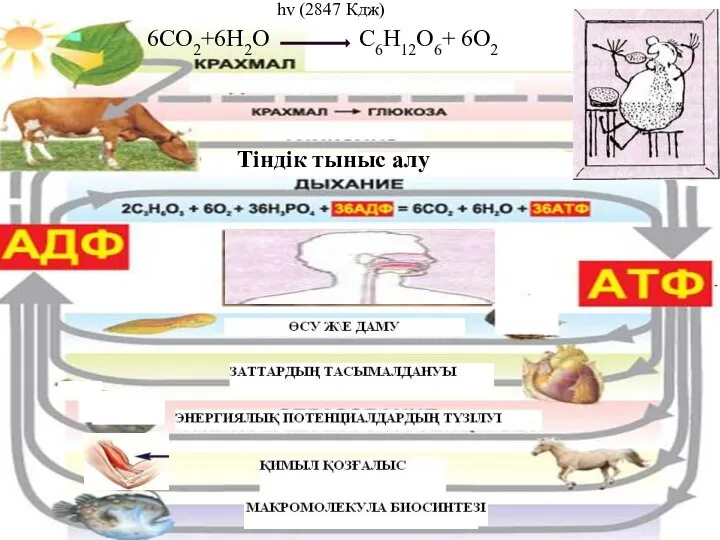 Биологиялық тотығу электрондардың тасымалдану тізбегі тотығудан фосфорлану
Биологиялық тотығу электрондардың тасымалдану тізбегі тотығудан фосфорлану Установка гидрокрекинга в составе завода глубокой переработки нефти ООО Кинеф
Установка гидрокрекинга в составе завода глубокой переработки нефти ООО Кинеф Зависимость свойств химических элементов от положения в ПСХЭ
Зависимость свойств химических элементов от положения в ПСХЭ Презентация по Химии "Химическая природа белка" - скачать смотреть
Презентация по Химии "Химическая природа белка" - скачать смотреть  АТФ (Аденозинтрифосфат)
АТФ (Аденозинтрифосфат) Азот. Физические и химические свойства азота
Азот. Физические и химические свойства азота Классификация и краткие характеристики основных групп токсикантов
Классификация и краткие характеристики основных групп токсикантов Хлороводород. Соляная кислота.
Хлороводород. Соляная кислота.  Уксусная кислота
Уксусная кислота Основания. Физические свойства оснований
Основания. Физические свойства оснований Плавиковая кислота или фтористоводородная кислота
Плавиковая кислота или фтористоводородная кислота Едкость Coca-Cola
Едкость Coca-Cola Химический элемент платина
Химический элемент платина Липидтер
Липидтер Подготовил учитель химии МОУ СОШ № 16 С. Александровского Александровского района Кононенко Светлана Юрьевна
Подготовил учитель химии МОУ СОШ № 16 С. Александровского Александровского района Кононенко Светлана Юрьевна Исследование содержания аскорбиновой кислоты в зимних сортах яблок, районированных в Петровском районе Ставропольского края
Исследование содержания аскорбиновой кислоты в зимних сортах яблок, районированных в Петровском районе Ставропольского края  Гравиметрические методы анализа
Гравиметрические методы анализа Дәрілік препараттардың синтезі мен олардың классификациясы
Дәрілік препараттардың синтезі мен олардың классификациясы Необратимый (совместный) гидролиз
Необратимый (совместный) гидролиз Хроматофокусирование: новые подходы в концентрировании и разделении
Хроматофокусирование: новые подходы в концентрировании и разделении