Содержание
- 2. Цели и задачи
- 3. Основные положения теории Бутлерова А. М.
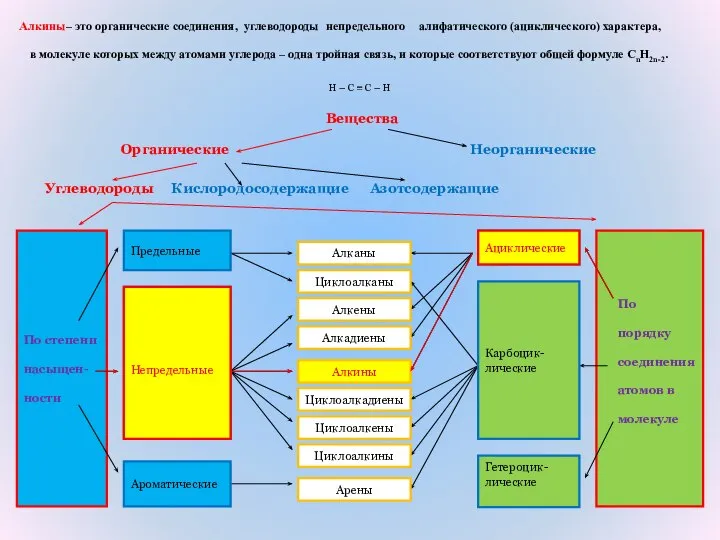
- 4. По степени насыщен- ности Вещества Органические Неорганические Углеводороды Кислородосодержащие Азотсодержащие По порядку соединения атомов в молекуле
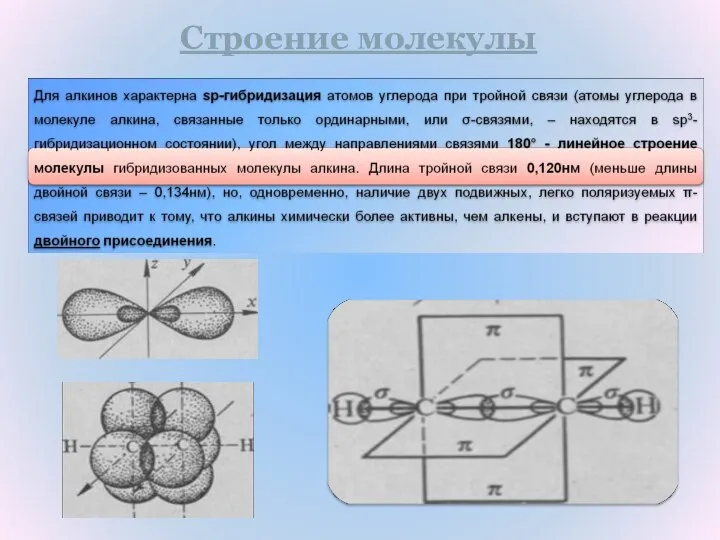
- 5. Строение молекулы
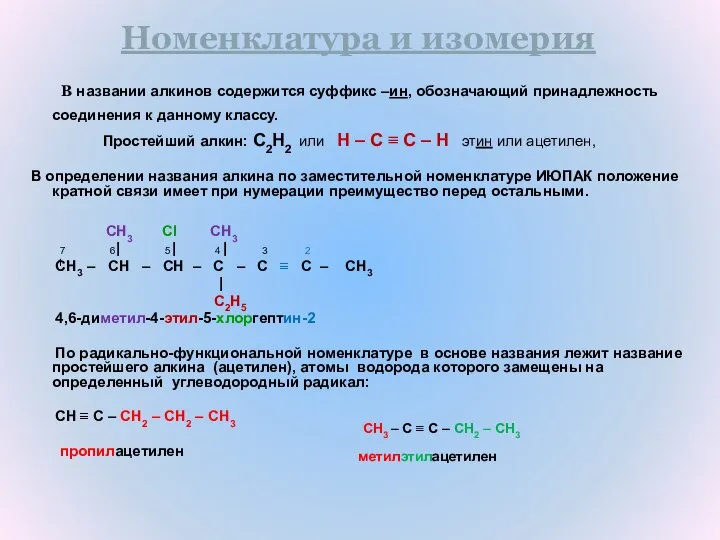
- 6. Номенклатура и изомерия В названии алкинов содержится суффикс –ин, обозначающий принадлежность соединения к данному классу. Простейший
- 7. Номенклатура и изомерия H H | | H – C – C ≡ C – C
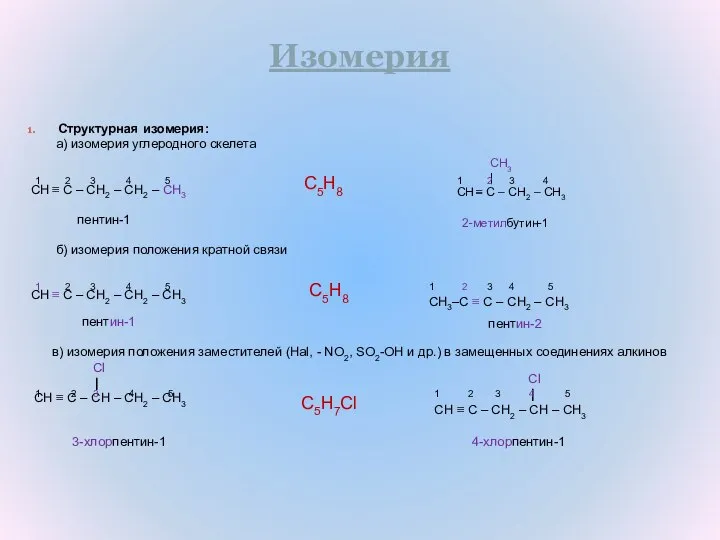
- 8. Изомерия Структурная изомерия: а) изомерия углеродного скелета CH ≡ C – CH2 – CH2 – CH3
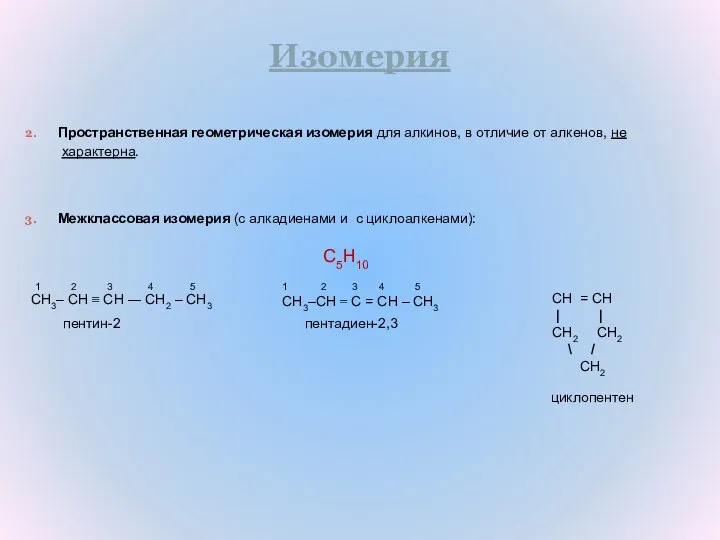
- 9. Изомерия Пространственная геометрическая изомерия для алкинов, в отличие от алкенов, не характерна. Межклассовая изомерия (с алкадиенами
- 10. Физические свойства Их температуры плавления и кипения, также как у алканов и алкенов, закономерно повышаются при
- 11. Химические свойства H – C ≡ C – H Реакции присоединения Реакции окисления Реакции замещения Реакции
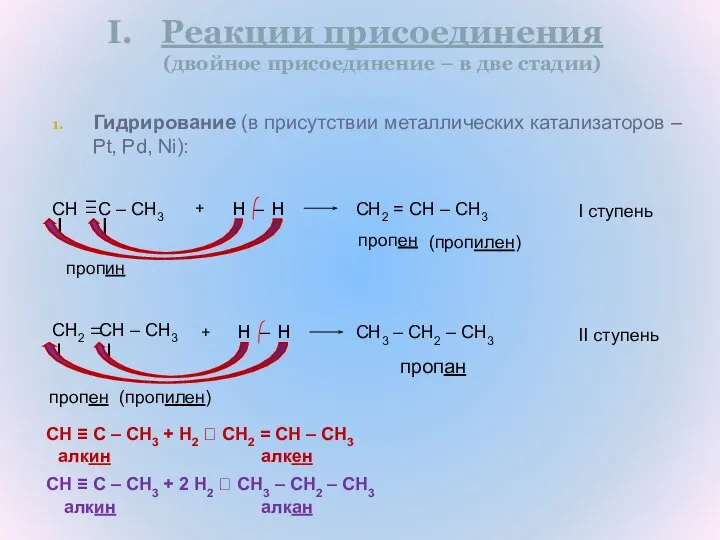
- 12. Гидрирование (в присутствии металлических катализаторов – Pt, Pd, Ni): CH C – CH3 пропан CH2 =
- 13. Галогенирование: CH C – CH3 CH = C – CH3 Реакции присоединения (двойное присоединение – в
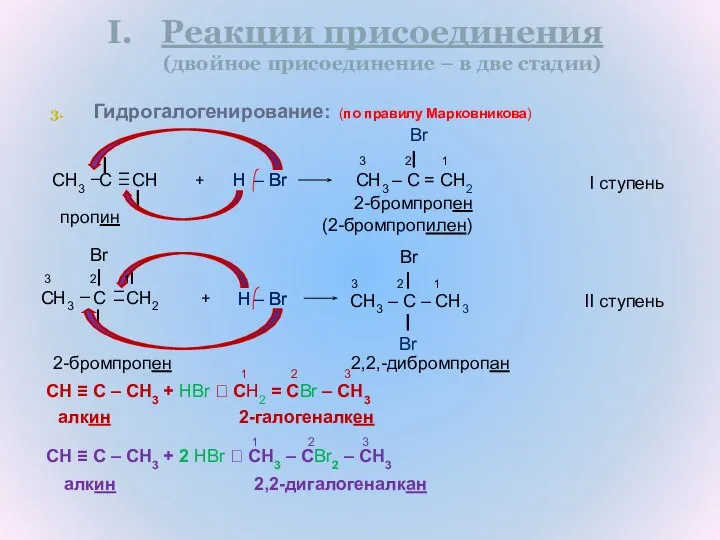
- 14. Гидрогалогенирование: CH3 C CH CH3 – C = CH2 Реакции присоединения (двойное присоединение – в две
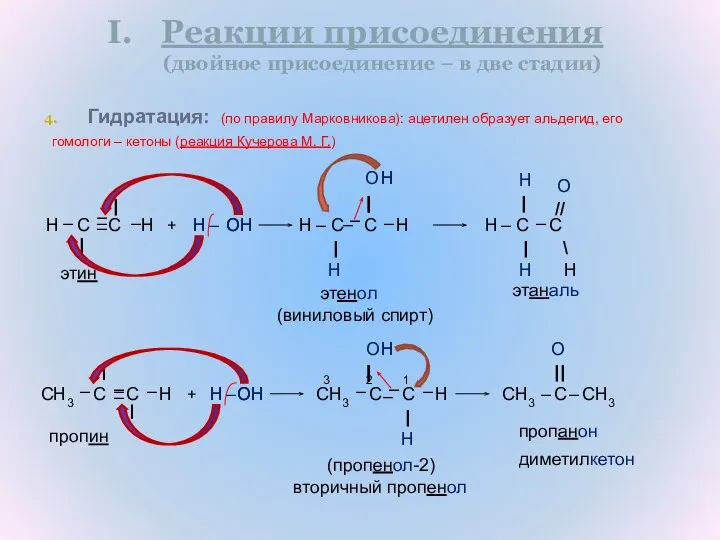
- 15. Гидратация: H C C H H – C C H Реакции присоединения (двойное присоединение – в
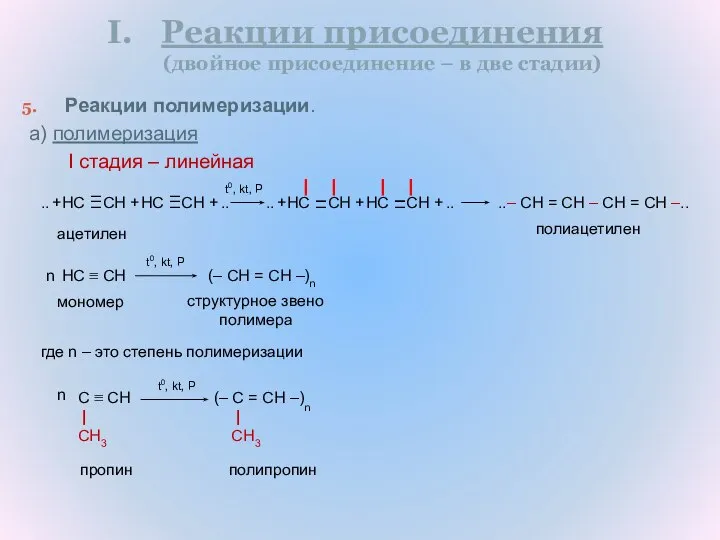
- 16. Реакции присоединения (двойное присоединение – в две стадии) Реакции полимеризации. а) полимеризация I стадия – линейная
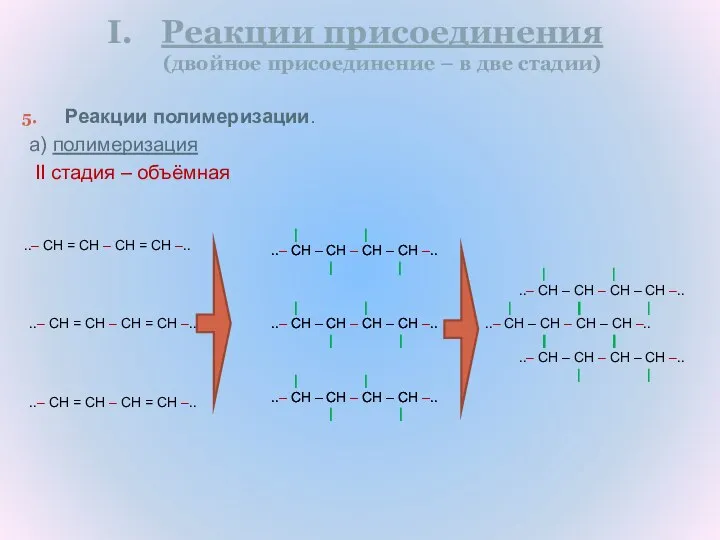
- 17. Реакции полимеризации. а) полимеризация II стадия – объёмная | | ..– CH – CH – CH
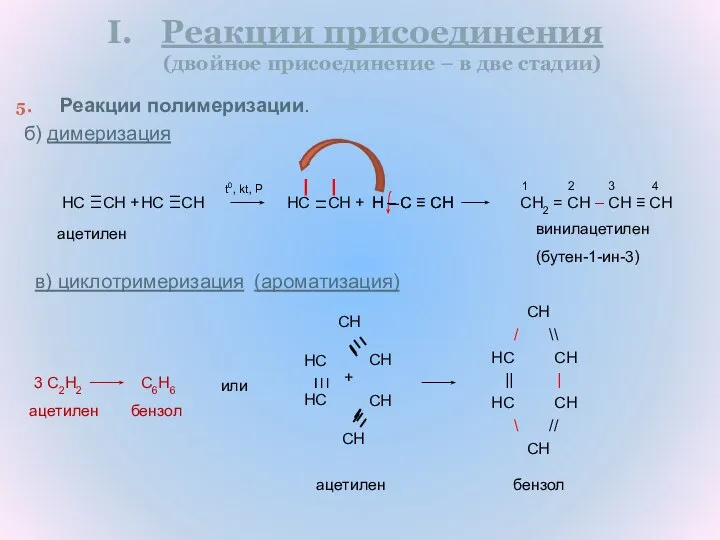
- 18. Реакции присоединения (двойное присоединение – в две стадии) Реакции полимеризации. б) димеризация CH2 = CH –
- 19. Реакции окисления Горение 2C2H2 + 5 O2 (избыток) ? 2C2H2 + 3 O2 (недостаток) ? 2C2H2
- 20. 2 3 Неполное окисление кислородом окислителя (KMnO4 в нейтральной среде, K2Cr2O7 в кислой среде) – конечным
- 21. C2H5 CH3 C2H5 CH3 Реакции окисления Из дизамещенных гомологов ацетилена при окислении образуются соответствующие R –
- 22. Реакции замещения (замещение атомов «H», связанных с sp-гибридизованными атомами углерода) Атомы водорода, связанные с sp-гибридизованными атомами
- 23. Реакции замещения (замещение атомов «H», связанных с sp-гибридизованными атомами углерода) Взаимодействие с металлическим натрием в жидком
- 24. Реакции замещения (замещение атомов «H», связанных с sp-гибридизованными атомами углерода) Взаимодействие с аммиачными растворами солей меди
- 25. Реакции замещения (замещение атомов «H», связанных с sp-гибридизованными атомами углерода) Взаимодействие с аммиачным раствором оксида серебра
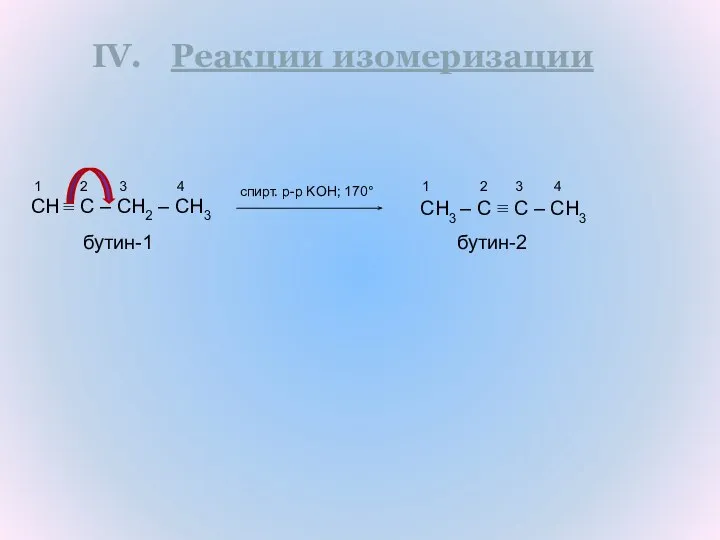
- 26. Реакции изомеризации CH ≡ C – CH2 – CH3 CH3 – C ≡ C – CH3
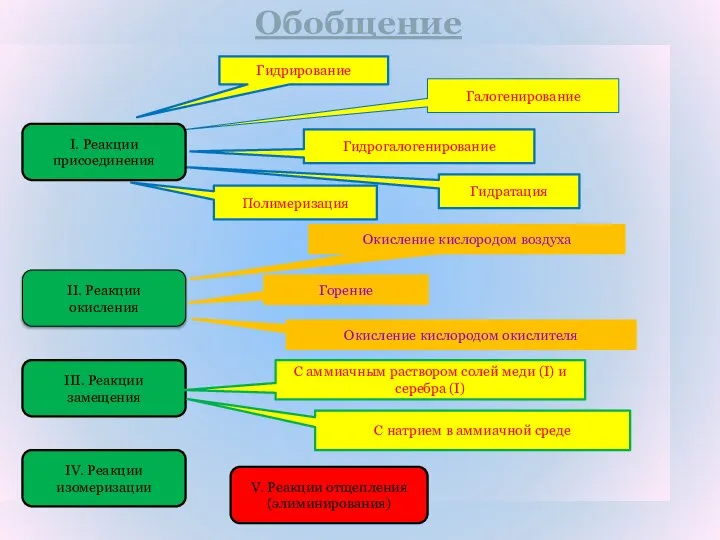
- 27. Обобщение II. Реакции окисления III. Реакции замещения IV. Реакции изомеризации Гидрирование Галогенирование Гидрогалогенирование Гидратация Полимеризация Горение
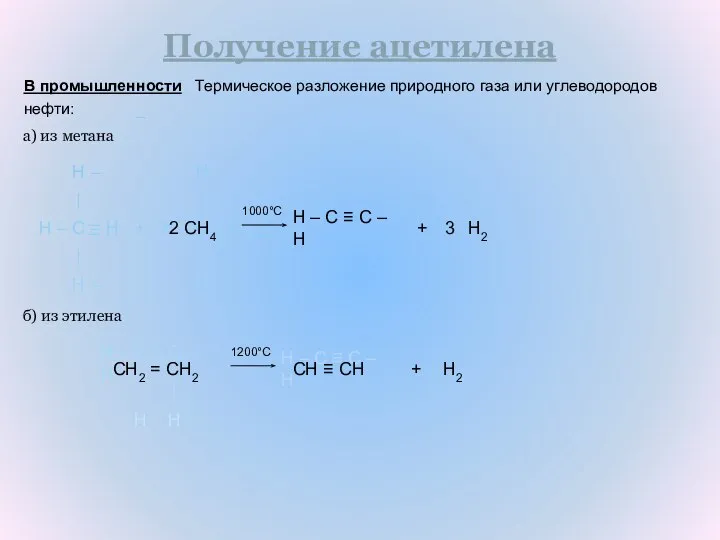
- 28. В промышленности Термическое разложение природного газа или углеводородов нефти: Получение ацетилена H – C – –
- 29. В лаборатории Гидролиз карбида кальция (реакция Велера Ф.) или карбидов других активных металлом (K, Mg) OH
- 30. CH3 – CH2 –C – C – CH3 Дегидрогалогенирование дигалогеналканов действием спиртового раствора щелочи или твердой
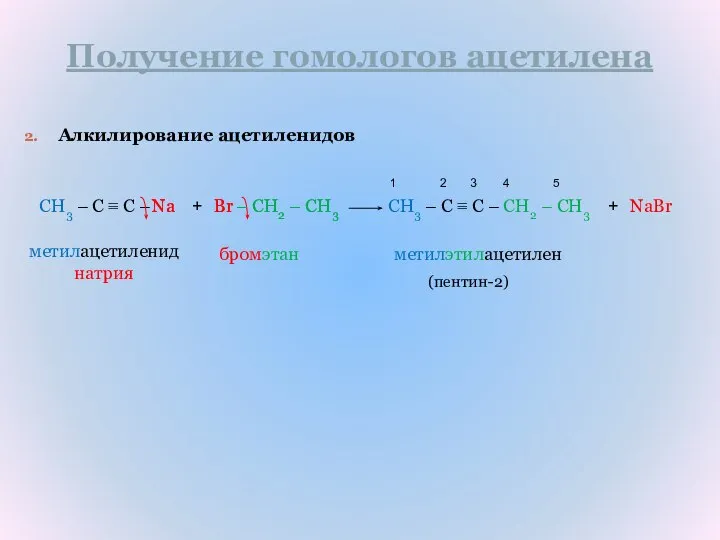
- 31. Получение гомологов ацетилена Алкилирование ацетиленидов CH3 – C ≡ C – – CH2 – CH3 Br
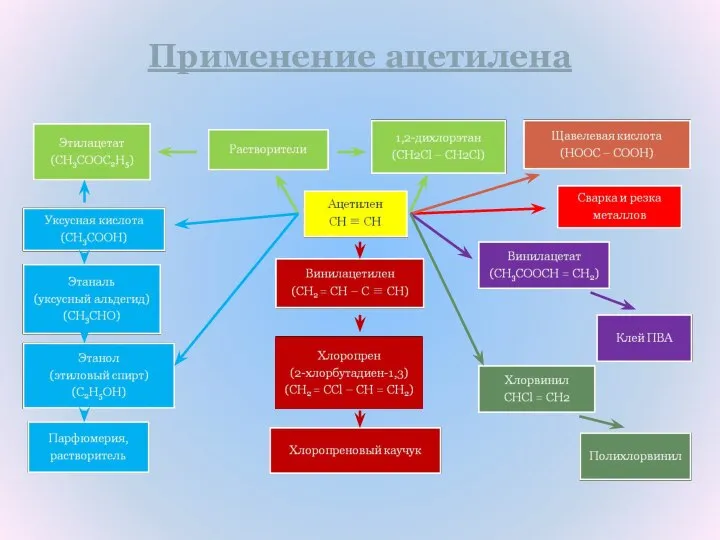
- 32. Применение ацетилена
- 34. Скачать презентацию















 Презентация по Химии "Моносахариды" - скачать смотреть
Презентация по Химии "Моносахариды" - скачать смотреть 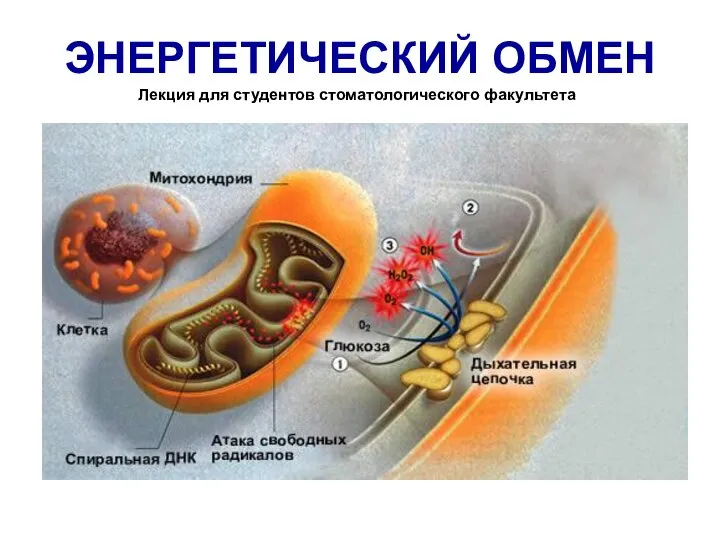 Энергетический обмен. Биологическое окисление
Энергетический обмен. Биологическое окисление Характеристика металу Sr
Характеристика металу Sr Технология производства простых полиэфиров
Технология производства простых полиэфиров Метаморфогенная серия. Группа регионального метаморфизма
Метаморфогенная серия. Группа регионального метаморфизма Азотная кислота
Азотная кислота Жиры. 9 класс
Жиры. 9 класс Презентация Спирты
Презентация Спирты Полярные электронные эффекты в органических соединениях
Полярные электронные эффекты в органических соединениях Щелочные и щелочноземельные металлы и их роль в организме человека
Щелочные и щелочноземельные металлы и их роль в организме человека Производство серной кислоты контактным способом
Производство серной кислоты контактным способом Презентация по Химии "Строение электронных оболочек атомов" - скачать смотреть
Презентация по Химии "Строение электронных оболочек атомов" - скачать смотреть  Тема урока Агрегатные состояния вещества. Плавление и отвердевание кристаллических тел.
Тема урока Агрегатные состояния вещества. Плавление и отвердевание кристаллических тел. Региональная металлогения
Региональная металлогения ГАЛОГЕНЫ И ИХ СОЕДИНЕНИЯ
ГАЛОГЕНЫ И ИХ СОЕДИНЕНИЯ  Биохимия нервной ткани. (Лекция 23)
Биохимия нервной ткани. (Лекция 23) Комплексные соединения
Комплексные соединения Химические свойства оснований. С какими из перечисленных веществ может реагировать данное вещество
Химические свойства оснований. С какими из перечисленных веществ может реагировать данное вещество Углерод Гончаров Никита 9 «Г» класс
Углерод Гончаров Никита 9 «Г» класс Резина и каучук
Резина и каучук Лаборатория мирового уровня в области термического анализа и физико-химии процессов тепловых методов добычи
Лаборатория мирового уровня в области термического анализа и физико-химии процессов тепловых методов добычи Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Физико-химия полимеров и их растворов
Физико-химия полимеров и их растворов 10 самых смертельно опасных камней и минералов
10 самых смертельно опасных камней и минералов Содержание химических элементов в организме. Макро- и микроэлементы
Содержание химических элементов в организме. Макро- и микроэлементы Аммиак
Аммиак Тяжёлая вода
Тяжёлая вода Растворы электролитов
Растворы электролитов