Содержание
- 2. СЛОЖНЫЕ ВЕЩЕСТВА Соединения первого порядка БИНАРНЫЕ Соединения высшего порядка МОЛЕКУЛЯРНЫЕ сложные вещества, которые получаются из простых
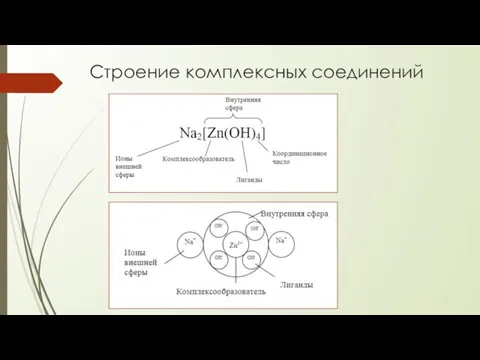
- 3. Строение комплексных соединений
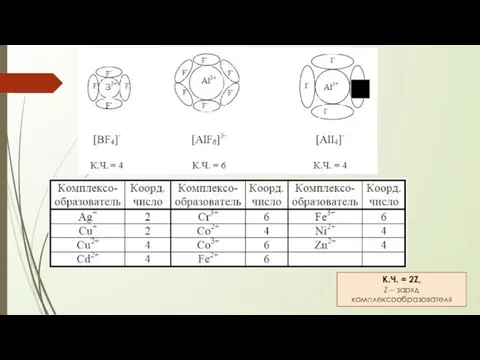
- 4. КОМПЛЕКСООБРАЗОВАТЕЛЬ положительно заряженные ионы d-элементов - чаще всего ионы р-элементов - иногда f-элементы - редко s-элементы
- 5. К.Ч. = 2Z, Z – заряд комплексообразователя
- 6. Классификация комплексных соединений Аквакомплексы Лигандами в этих соединениях являются молекулы воды (H2O) [Ti(H2O)6]Cl3 Аммиакатные комплексы Лигандами
- 7. Номенклатура комплексных соединений Сначала указывают название аниона, а затем катиона, то есть действует то же правило,
- 8. примеры [Cr(H2O)6]Cl3 – хлорид гексааква хрома (III); [Cu(NH3)4]SO4 – сульфат тетрааммин меди; K4[Zn(OH)4] – тетрагидроксоцинкат калия;
- 9. Признаки образования комплексных соединений ИЗМЕНЕНИЕ ЦВЕТА РАСТВОРА CuSO4 + 4NH3 = [Cu(NH3)4]SO4 бледно-голубой бесцветный ярко-синий РАСТВОРЕНИЕ
- 10. ДИССОЦИАЦИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Все растворимые комплексные соединения – сильные электролиты, полностью диссоциирующие в растворах на комплексный
- 12. Константа нестойкости Константа нестойкости (Кн): - характеризует прочность комплексного иона - по сути является константой диссоциации
- 14. Скачать презентацию




![примеры [Cr(H2O)6]Cl3 – хлорид гексааква хрома (III); [Cu(NH3)4]SO4 – сульфат тетрааммин](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/567315/slide-7.jpg)




 Урок :Углерод (9 класс) Автор:Ахметвалиева НаиляМисбаховна , учитель химии ГБОУ ООШ п.Приморский м.р.Ставропольский Самарской области Углерод Углеро́д — химический элемент 4-ой группы главной подгруппы 2-го периода периодической системы Менделеева, по
Урок :Углерод (9 класс) Автор:Ахметвалиева НаиляМисбаховна , учитель химии ГБОУ ООШ п.Приморский м.р.Ставропольский Самарской области Углерод Углеро́д — химический элемент 4-ой группы главной подгруппы 2-го периода периодической системы Менделеева, по Презентация по Химии "Агрегатные состояния вещества" - скачать смотреть
Презентация по Химии "Агрегатные состояния вещества" - скачать смотреть  Цинк (Zn). Свойства
Цинк (Zn). Свойства Металлы и сплавы, Металлы и сплавы, их свойства и применение в радиоэлектронной аппаратуре Подготовил: учащийся гр.7/8 профессия
Металлы и сплавы, Металлы и сплавы, их свойства и применение в радиоэлектронной аппаратуре Подготовил: учащийся гр.7/8 профессия Көміртегінің мөлшері бойынша легірленген болаттың классификациясы
Көміртегінің мөлшері бойынша легірленген болаттың классификациясы Методы комплексонометрии. Количественный анализ
Методы комплексонометрии. Количественный анализ Особенности строения, реакционной способности и методы синтеза азотсодержащих соединений
Особенности строения, реакционной способности и методы синтеза азотсодержащих соединений Функциональные производные с простой связью C-“O”. Часть 4 (продолжение) …окси-производные
Функциональные производные с простой связью C-“O”. Часть 4 (продолжение) …окси-производные Строение атома
Строение атома Лекарственные средства, относящиеся к производным пиридина : производные никотиновой и изоникотиновой кислоты
Лекарственные средства, относящиеся к производным пиридина : производные никотиновой и изоникотиновой кислоты Силикатное производство
Силикатное производство Сказка про Азотную кислоту
Сказка про Азотную кислоту Количество вещества, число Авогадро, молярная масса, молярный объём, уравнение связи
Количество вещества, число Авогадро, молярная масса, молярный объём, уравнение связи Диеновые углеводороды
Диеновые углеводороды Презентация Природные источники углеводородов
Презентация Природные источники углеводородов  Презентация по Химии "Презентация Ионы и ионная химическая связь" - скачать смотреть
Презентация по Химии "Презентация Ионы и ионная химическая связь" - скачать смотреть  Оже спектроскопия
Оже спектроскопия Периодический закон. Периодическая система элементов. (Лекция 2)
Периодический закон. Периодическая система элементов. (Лекция 2) Витамин В2 Презентация по химии выполнена учеником 10 «В» класса Зверевым Вениамином
Витамин В2 Презентация по химии выполнена учеником 10 «В» класса Зверевым Вениамином Спирты. Классификация спиртов
Спирты. Классификация спиртов Соли азотной кислоты
Соли азотной кислоты Соединения галогенов
Соединения галогенов Химико – математические проценты
Химико – математические проценты Сплавы железа с углеродом
Сплавы железа с углеродом Жиры и масла в косметическом производстве
Жиры и масла в косметическом производстве Алкалоиды природного происхождения
Алкалоиды природного происхождения Отравляющие вещества
Отравляющие вещества  Элективный курс "Решение задач по химии повышенного уровня сложности"
Элективный курс "Решение задач по химии повышенного уровня сложности"