Содержание
- 2. Ответьте на вопросы: Почему органическую химию называют химией соединений карбона? Составьте схему строения атома карбона.
- 3. Назовите возможные валентности и степени окисления атома карбона? Почему атомы карбона могут образовывать химические связи друг
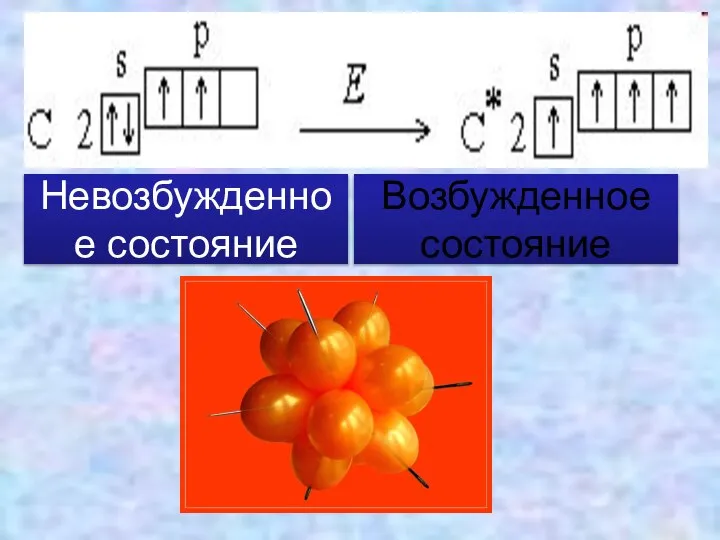
- 4. Рассмотрим строение внешнего электронного уровня атома карбона:
- 5. Невозбужденное состояние Возбужденное состояние
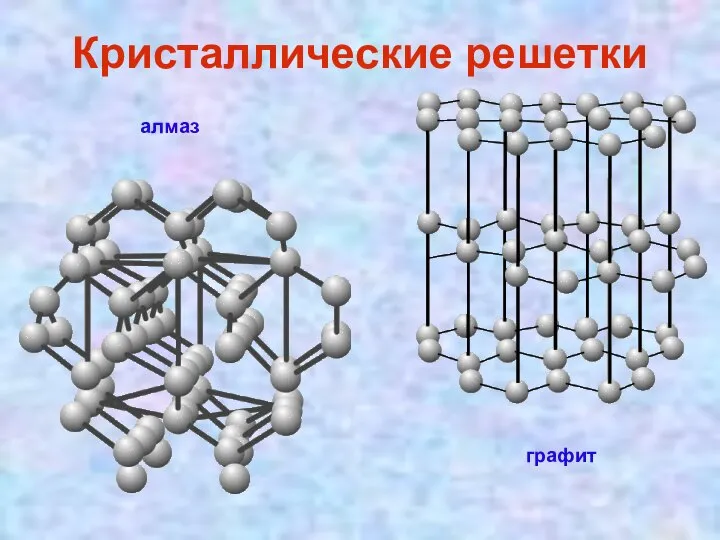
- 6. Углерод в природе встречается в виде алмаза и графита. В ископаемых углях его содержится: от 92
- 7. В реакциях с металлами и менее активными неметаллами углерод - окислитель: 2C+H2=C2H2 C+Si=SiC 2C+Ca=CaC2 3C+4Al=Al4C3 Карбид
- 8. Кристаллические решетки алмаз графит
- 9. бесцветное кристаллическое вещество с атомной решеткой. Каждый атом углерода в алмазе окружен четырьмя другими, расположенными от
- 10. Виды алмазов Хоуп страз Тиффани Нассак 90 карат Принцесса Орлов Горняк Зелёный дрезденский
- 11. Графит Графит обладает тремя практически важными свойствами: Тугоплавкость Отсутствие на его поверхности каких-либо продуктов взаимодействия с
- 12. Теория химического строения А.М. Бутлерова В 1861 году на съезде немецких натуралистов Бутлеров докладывал о новых
- 13. Он выдвинул новое понятие – «СТРУКТУРА» Так родилась теория химического строения
- 14. Основные положения теории: 1. В молекулах веществ существует последовательность химического соединения атомов соответственно их валентности, которая
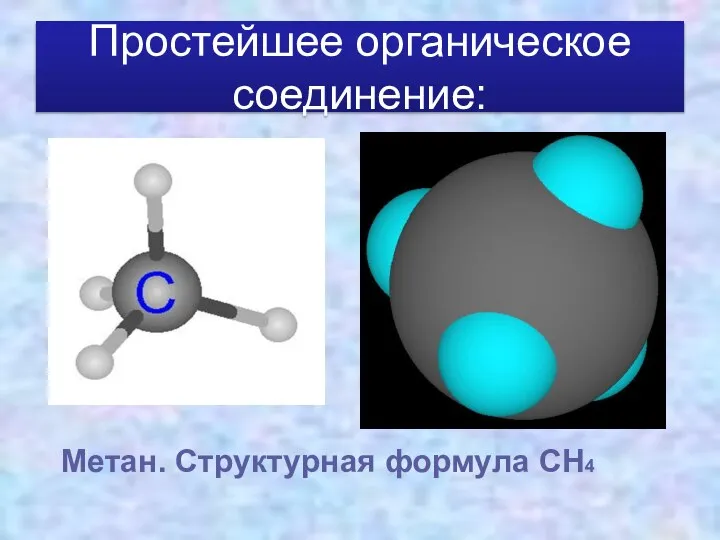
- 15. Простейшее органическое соединение: Метан. Структурная формула СН4
- 16. 2. Химические особенности веществ определяются природой элементарных составляющих, их количеством и порядком соединения. Основные положения теории:
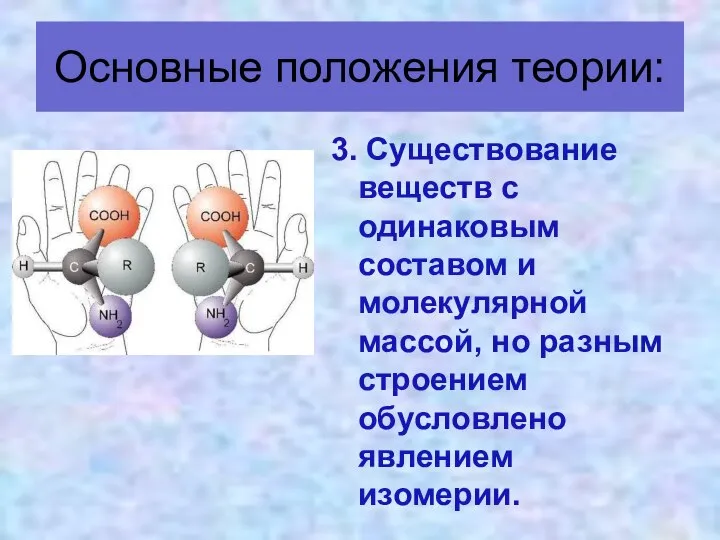
- 17. 3. Существование веществ с одинаковым составом и молекулярной массой, но разным строением обусловлено явлением изомерии. Основные
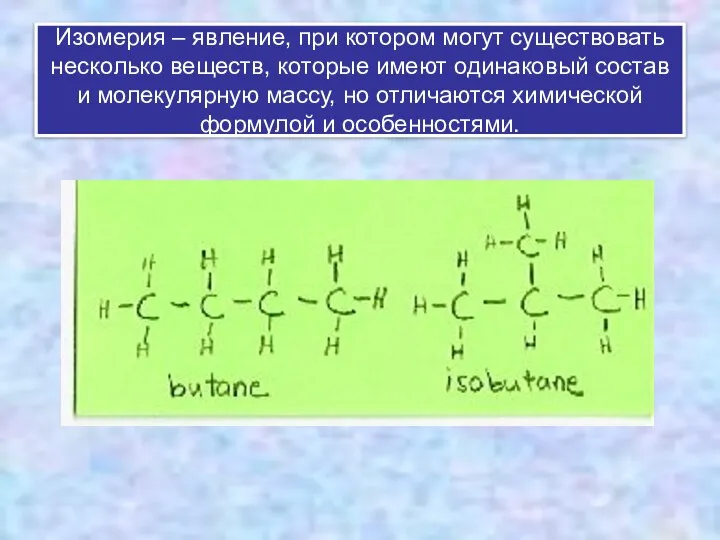
- 18. Изомерия – явление, при котором могут существовать несколько веществ, которые имеют одинаковый состав и молекулярную массу,
- 19. 4. Т.к. в конкретных реакциях изменяются только некоторые части молекулы, то исследование строения продукта реакции помогает
- 20. 5. Химическая природа отдельных атомов молекулы изменяется в зависимости от окружения, т.е. от того, с какими
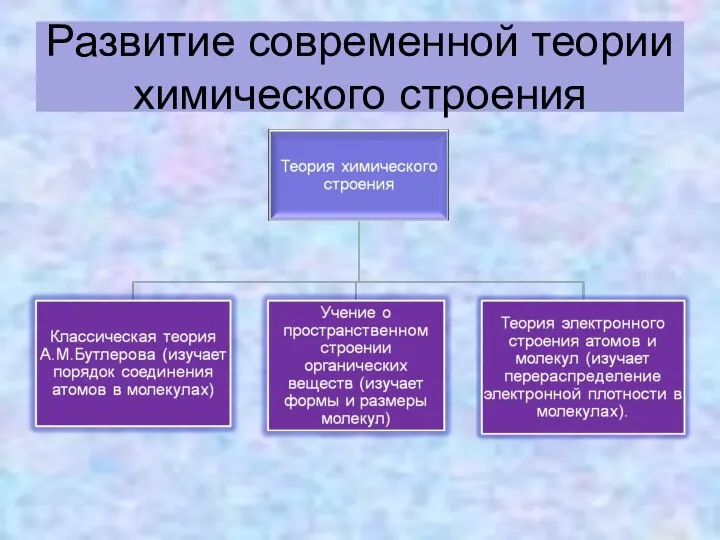
- 21. Развитие современной теории химического строения
- 23. Скачать презентацию













 Свойства неорганических веществ: 8 и 9 задания
Свойства неорганических веществ: 8 и 9 задания Силикаты. Пироксены. Амфиболы. Полевые шпаты
Силикаты. Пироксены. Амфиболы. Полевые шпаты Классификация гомеопатических лекарственных средств
Классификация гомеопатических лекарственных средств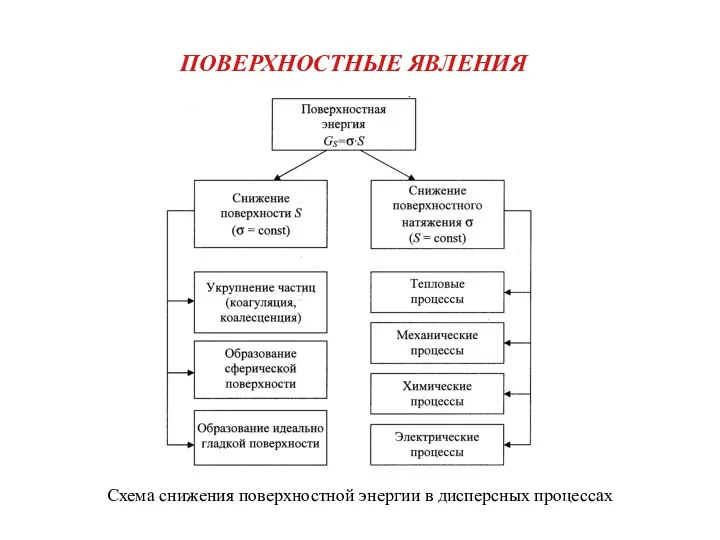 Поверхностные явления
Поверхностные явления Эндогенная серия. Вулканогенно-осадочная группа
Эндогенная серия. Вулканогенно-осадочная группа Використання кислот в будівництві і побуті. 8 клас
Використання кислот в будівництві і побуті. 8 клас Исследовательская работа Химические средства в быту
Исследовательская работа Химические средства в быту Radiation-induced desorption of excited atoms from solid nitrogen
Radiation-induced desorption of excited atoms from solid nitrogen Свободные радикалы. Активные формы кислорода
Свободные радикалы. Активные формы кислорода Химический состав молока
Химический состав молока Серебро
Серебро Современные тенденции развития химии
Современные тенденции развития химии Липиды (Жиры)
Липиды (Жиры) Разработка методики расчета фазового равновесия при длительном хранении СПГ
Разработка методики расчета фазового равновесия при длительном хранении СПГ Фізичні та хімічні явища
Фізичні та хімічні явища Гидролиз
Гидролиз Презентация по Химии "Нефть. Крекинг" - скачать смотреть
Презентация по Химии "Нефть. Крекинг" - скачать смотреть  Диффузия золота и свинца
Диффузия золота и свинца Структура и текстура магматических пород
Структура и текстура магматических пород Решение задач
Решение задач Галогены. Фтор, хлор, бром, йод, астат
Галогены. Фтор, хлор, бром, йод, астат Химия
Химия Ароматичні аміни
Ароматичні аміни Кондуктометрия. Кондуктометрия әдісі. Электрохимиялық әдістер
Кондуктометрия. Кондуктометрия әдісі. Электрохимиялық әдістер Синтез наноматериалов золь-гель методом. (Лекция 5)
Синтез наноматериалов золь-гель методом. (Лекция 5) Алюминий Интересные факты
Алюминий Интересные факты  Биологические мембраны. Структурная организация
Биологические мембраны. Структурная организация Углеводы. Классификация углеводов
Углеводы. Классификация углеводов