Презентация по Химии "Оксиды. Состав. Классификация. Номенклатура. Свойства. Получение. Применение" - скачать смотреть бесплат
Содержание
- 2. Определи свое эмоциональное состояние
- 3. Создать условия для изучения классификации неорганических веществ и самостоятельному применению знаний в сходной и новой ситуациях.
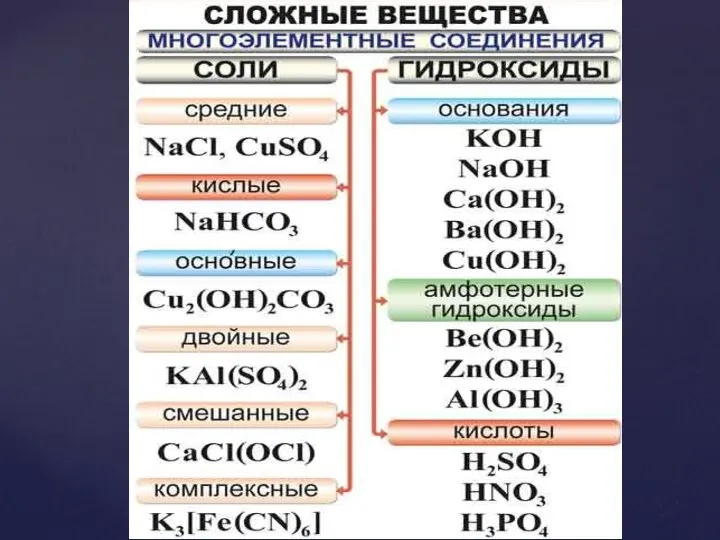
- 4. Простые и сложные вещества; Классификация и номенклатура; Оксиды; Основания; Кислоты; Соли. Основные понятия:
- 9. Кислород, спрятанный в камне
- 10. «Оксиды. Состав. Классификация. Номенклатура. Свойства. Получение. Применение»
- 11. Демонстрационный эксперимент: «Образцы оксидов»
- 12. Оксиды; Состав; Классификация; Номенклатура; Свойства; Получение; Применение. Основные понятия:
- 13. (окисел, окись) — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам
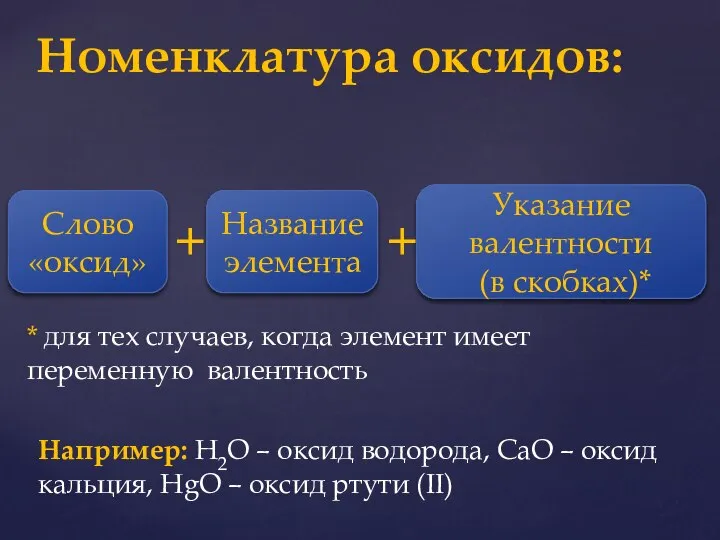
- 14. Номенклатура оксидов: Слово «оксид» + Название элемента Указание валентности (в скобках)* + * для тех случаев,
- 15. 1. Солеобразующие: Основной оксид (МеО - Wме – I, II) Амфотерный оксид (МеО - Wме –
- 16. Оксид серы (IV); Оксид калия; Оксид алюминия; Оксид железа (II); Оксид железа (III); Оксид марганца (VII);
- 17. Оксид серы (IV) – SO2 - кислотный ; Оксид калия – K2O - основной; Оксид алюминия
- 18. Химичим от души, но не забываем о технике безопасности!
- 19. Задания по группам – лабораторный опыт 1 ряд - «Химические свойства основных оксидов»; 2 ряд -
- 20. 1. ... + H2O → МеОН (р) 2. ... + HR → MeR + H2O 3.
- 21. ... + H2O → HR (р) ... + MeOH(р) → MeR + H2O ... + основной
- 22. ... + HR (р) → MeR + H2O ... + MeOH(р) → MeR + H2O Лабораторный
- 23. 1. Рассмотреть химические свойства: 1 ряд – оксид лития; 2 ряд – оксид азота (IV); 3
- 24. Оксиды- это вещества реальные или виртуальные?
- 25. Непосредственное соединение простого вещества с кислородом; Горение сложных веществ; Разложение при нагревании кислородных соединений: карбонатов, нитратов,
- 26. 1. Непосредственное соединение простого вещества с кислородом (демонстрационый эксперимент): Получение оксидов:
- 27. 2. Горение сложных веществ (демонстрационный эксперимент): Этанол + кислород → оксид углерода (IV) + оксид водорода;
- 28. 3. Разложение при нагревании кислородных соединений: карбонатов, нитратов, нерастворимых оснований: Нитрат меди (II) → оксид меди
- 29. Самоконтроль и самокоррекция
- 30. 1. Сложные вещества делят на …; 2. Основной оксид - …; 3. Кислотный оксид - …;
- 31. 1. Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород; 2. Неметаллы обладают
- 32. 1. Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород; 2. Неметаллы обладают
- 33. 1. Литий, вода, натрий, алюминий; 2. Фосфор, сера, кремний, железо; 3. Оксид бария, оксид фосфора (V),
- 34. 1. Fe(OH)2; Cu(OH)2; NaOH; Zn(OH)2; 2. Na2O; BeO; CaO; CuO; 3. H2SO4; HClO4; H2S; H2CO3; 4.
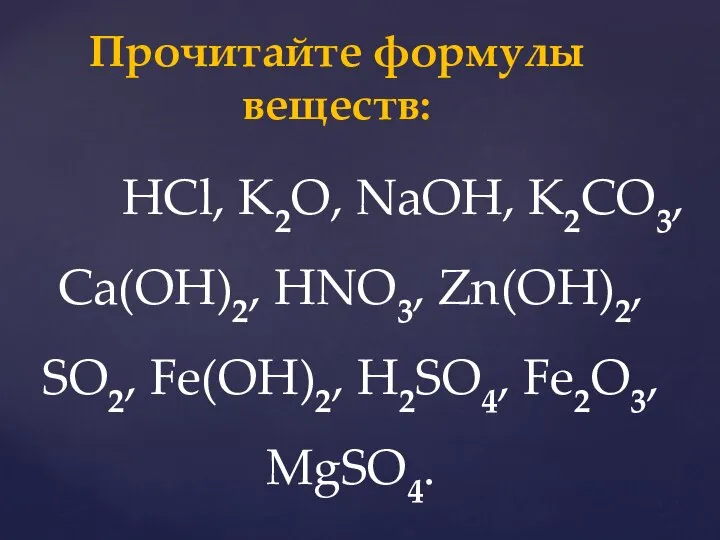
- 35. HCl, K2O, NaOH, K2CO3, Ca(OH)2, HNO3, Zn(OH)2, SO2, Fe(OH)2, H2SO4, Fe2O3, MgSO4. Прочитайте формулы веществ:
- 36. 1. Бромид железа (III); 2. Сульфат марганца (II); 3. Гидросульфид натрия; 4. Дихромовая кислота; 5. Нитрат
- 37. - Знаю – - Узнал – - Хочу узнать – Рефлексия
- 38. Определи свое эмоциональное состояние
- 40. Скачать презентацию


































 Алмаз. Внутренняя структура алмаза
Алмаз. Внутренняя структура алмаза Презентация по Химии "Карбоновые кислоты 9 класс" - скачать смотреть
Презентация по Химии "Карбоновые кислоты 9 класс" - скачать смотреть  Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Условия осаждения и растворения. (Глава 4. § 19. Задача 11)
Условия осаждения и растворения. (Глава 4. § 19. Задача 11) Углерод. Металлы. 9 класс
Углерод. Металлы. 9 класс Исследовательский проект по теме Удивительный мир кристаллов
Исследовательский проект по теме Удивительный мир кристаллов Классификация ненасыщенных углеводородов
Классификация ненасыщенных углеводородов Галогены. Физические свойства
Галогены. Физические свойства Уксусная кислота
Уксусная кислота Реакции окисления-восстановления в химическом анализе. (Лекция 8.1)
Реакции окисления-восстановления в химическом анализе. (Лекция 8.1) Щелочные металлы
Щелочные металлы Алотропні видозміни Карбона та їх застосування Розмаїтого Дмитра
Алотропні видозміни Карбона та їх застосування Розмаїтого Дмитра  Сульфатна кислота
Сульфатна кислота  Оксиды, свойства и способы получения
Оксиды, свойства и способы получения Качественное и количественное определение содержания аскорбиновой кислоты в продуктах питания
Качественное и количественное определение содержания аскорбиновой кислоты в продуктах питания Минерал турмалин
Минерал турмалин Бензофураны и бензотиофены. Общие методы синтеза
Бензофураны и бензотиофены. Общие методы синтеза Молекулярные массы и гибкость полимеров
Молекулярные массы и гибкость полимеров Аппараты основных химических производств
Аппараты основных химических производств Презентация Алкены
Презентация Алкены Платина. Физические и химические свойства
Платина. Физические и химические свойства Становление органической химии как отдельной науки. (Модуль 1)
Становление органической химии как отдельной науки. (Модуль 1) Комплексные соединения
Комплексные соединения Gas hydrates
Gas hydrates Моделирование, как метод научного исследования. Ограниченный метод Хартри-Фока
Моделирование, как метод научного исследования. Ограниченный метод Хартри-Фока Волокна Презентація на тему:
Волокна Презентація на тему:  Гидролиз солей
Гидролиз солей Органическая химия. Глицерин
Органическая химия. Глицерин