Содержание
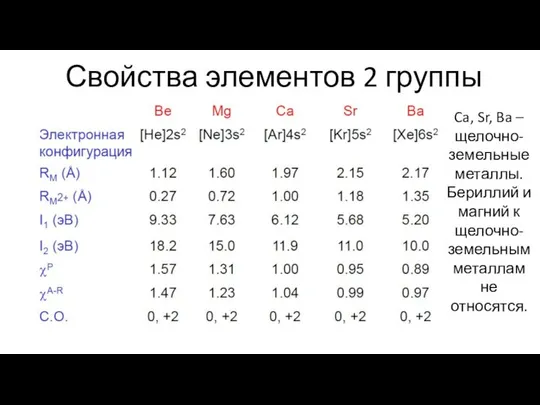
- 2. Свойства элементов 2 группы Ca, Sr, Ba – щелочно-земельные металлы. Бериллий и магний к щелочно-земельным металлам
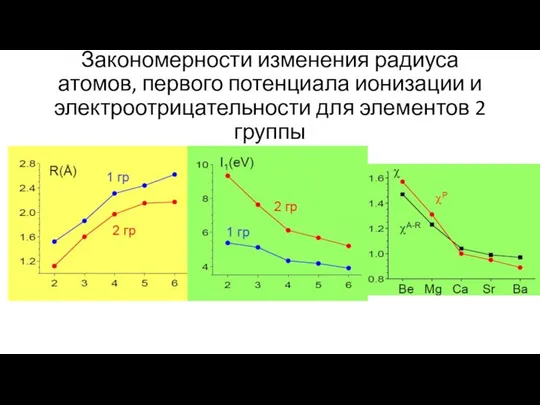
- 3. Закономерности изменения радиуса атомов, первого потенциала ионизации и электроотрицательности для элементов 2 группы
- 4. Металлы 2 группы Бериллий и магний имеют гексагональную решетку: Кристаллическая решетка кальция и стронция – гранецентрированная
- 5. Бериллий. Нахождение в природе и получение Основной минерал бериллия – берилл Аl2(Ве3[Si6O18]) Примесь ионов хрома(III) окрашивает
- 6. Структура берилла Атомы бериллия находятся в центре тетраэдров [BeO4]. Атомы алюминия в центре октаэдров [AlO6]. При
- 7. Разделение соединений Be2+ и Al3+ может быть проведено карбонатным способом. При действии избытка карбоната аммония в
- 8. 4. Хлоридный метод. Берилл нагревают в атмосфере хлора в присутствии угля (1000 °С): Be3Al2[Si6O18] + 18
- 9. Бериллий переводят во фторид и восстанавливают магнием. Бериллий и магний не образуют сплава, т.к. размеры их
- 10. 1. Получение магния из доломита – термический процесс: Силикотермический процесс CaCO3⋅MgCO3 CaO⋅MgO + 2 CO2. 2(CaO⋅MgO)
- 11. Кальций в природе (1,5 масс.%): CaSO4⋅2H2O – гипс CaCO3 – мрамор, известняк. Металлический кальций получают в
- 12. Бериллий и его соединения Химическая активность бериллия ниже, чем у других элементов группы, хотя E°(Be2+/Be) =
- 13. Бериллий реагирует с разбавленными растворами кислот (HCl, H2SO4, HNO3), но пассивируется концентрированной HNO3. Взаимодействует с растворами
- 14. Галогениды бериллия Безводные галогениды бериллия нельзя получить из водных растворов из-за образования гидратов и их последующего
- 15. Оксиды и гидроксиды бериллия BeO амфотерен и растворяется как в кислотах, так и в щелочах: BeO
- 16. Соли кислородсодержащих кислот бериллия Большинство солей бериллия хорошо растворимы в воде и заметно гидролизованы при комнатной
- 17. Координационные соединения бериллия Ве более склонен, по сравнению с другими элементами группы, к образованию координационных соединений
- 18. Особенности химии бериллия Причины: Малый радиус атома и иона бериллия. Большее, по сравнению с другими элементами
- 19. Магний Магний – гораздо более активный по сравнению с бериллием металл (E°(Mg2+/Mg) = −2,36 В(с.в.э.), но
- 20. Магний, будучи активным металлом, реагирует с растворами кислот: Mg + H2SO4разб → MgSO4 + H2 4
- 21. Оксиды магния и щелочно-земельных металлов Оксиды магния и щелочно-земельных металлов обладают основным характером. Однако прокаливание MgO,
- 22. Гидрид магния В отличие от гидрида бериллия, гидрид магния может быть получен из элементов, хотя и
- 23. Соли магния В водном растворе соли магния гидролизованы, хотя и в значительно меньшей степени по сравнению
- 24. Обезвоживание кристаллогидратов хлорида магния. Образование оксогалогенидов
- 25. Щелочно-земельные металлы Реагируют с водой при комнатной температуре: Ca + 2 H2O → Ca(OH)2 + H2.
- 26. 4. Образуют солеподобные гидриды Ca + H2 → CaH2 CaH2 + 2 H2O → Ca(OH)2 +
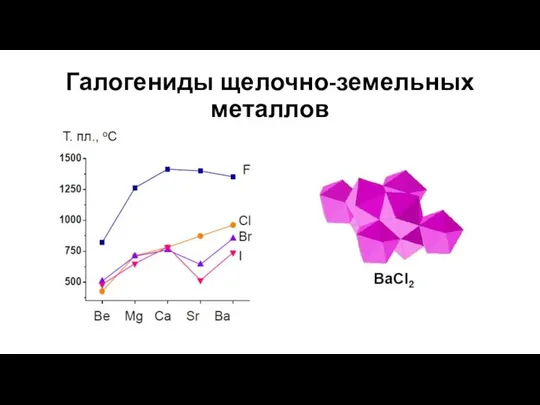
- 27. Галогениды щелочно-земельных металлов
- 28. Соли щелочно-земельных металлов Растворимые соли гидролизу практически не подвергаются CaCl2 + Na2CO3 + [H2O] → CaCO3↓
- 29. CaSO4 растворяется в концентрированной серной кислоте: CaSO4 + H2SO4 → H2[Ca(SO4)2] и даже в концентрированном растворе
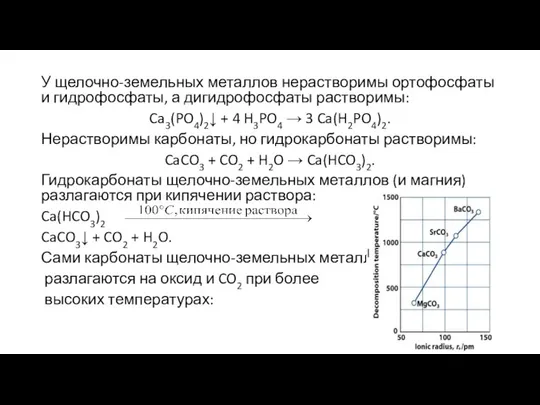
- 30. У щелочно-земельных металлов нерастворимы ортофосфаты и гидрофосфаты, а дигидрофосфаты растворимы: Ca3(PO4)2↓ + 4 H3PO4 → 3
- 31. Растворимость хроматов щелочно-земельных металлов также резко уменьшается от кальция к барию: ПР (CaCrO4) = 7,1⋅10−4, ПР
- 32. Жесткость воды Жесткость воды (ммоль экв/л) вызвана присутствием растворимых солей кальция и магния. Следствие – возможность
- 33. Координационные соединения магния и щелочно-земельных металлов Магний и кальций образуют относительно устойчивые комплексы с полидентатными лигандами.
- 35. Цемент Цемент (caementum — «щебень, битый камень») — искусственное неорганическое гидравлическое вяжущее вещество. Портландцемент получается при
- 39. Скачать презентацию


![Структура берилла Атомы бериллия находятся в центре тетраэдров [BeO4]. Атомы алюминия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/692405/slide-5.jpg)





















![CaSO4 растворяется в концентрированной серной кислоте: CaSO4 + H2SO4 → H2[Ca(SO4)2]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/692405/slide-28.jpg)






 Аттестационная работа. Методика по химии 9 класс Исследовательская деятельность в решении экспериментальных задач
Аттестационная работа. Методика по химии 9 класс Исследовательская деятельность в решении экспериментальных задач Подготовка к ГИА. Тренажер по химии
Подготовка к ГИА. Тренажер по химии Сложные реакции
Сложные реакции Карбоновые кислоты и их производные
Карбоновые кислоты и их производные Мило. Мийні засоби
Мило. Мийні засоби  EdExcel Unit C2 – Discovering Chemistry
EdExcel Unit C2 – Discovering Chemistry Качественные реакции. Катионы
Качественные реакции. Катионы Предмет органической химии.
Предмет органической химии. Шкала рН. Функции воды в организме
Шкала рН. Функции воды в организме В таблиці я ― відомий елемент, Та літеру зміни з одного боку, Переконаєшся в один момент, Що я не елемент вже, а протока. Метаграми
В таблиці я ― відомий елемент, Та літеру зміни з одного боку, Переконаєшся в один момент, Що я не елемент вже, а протока. Метаграми  Обмен белков. Источники и пути обезвреживания аммиака. (Лекция 15)
Обмен белков. Источники и пути обезвреживания аммиака. (Лекция 15) Общие пути обмена аминокислот. (Лекция 11)
Общие пути обмена аминокислот. (Лекция 11) Презентация по Химии "Окислительно-восстановительные реакции" - скачать смотреть бесплатно
Презентация по Химии "Окислительно-восстановительные реакции" - скачать смотреть бесплатно Катализ. Модели катализа
Катализ. Модели катализа Галогенопроизводные и их общая формула
Галогенопроизводные и их общая формула Молекулярно-кинетические свойства
Молекулярно-кинетические свойства Основи, їх склад, назви, класифікація
Основи, їх склад, назви, класифікація Химический элементы в нашей жизни
Химический элементы в нашей жизни Вещества преимущественно удушающего действия (пульмонотоксиканты)
Вещества преимущественно удушающего действия (пульмонотоксиканты) Презентация "Карбоновые кислоты"
Презентация "Карбоновые кислоты" Моющие средства
Моющие средства Этиленгликоль. Физические свойства
Этиленгликоль. Физические свойства Фосфонсірке қышқылының антипирендік қасиеттерін зерттеу
Фосфонсірке қышқылының антипирендік қасиеттерін зерттеу Презентация по Химии "Химические свойства алюминия" - скачать смотреть
Презентация по Химии "Химические свойства алюминия" - скачать смотреть  Польза и вред химического производства
Польза и вред химического производства Полупроводниковая магнитная керамика - ферриты
Полупроводниковая магнитная керамика - ферриты Фильтрационные свойства.Решение уравнений Стокса для несжимаемой жидкости
Фильтрационные свойства.Решение уравнений Стокса для несжимаемой жидкости Состав, строение и свойства аминокислот
Состав, строение и свойства аминокислот