*
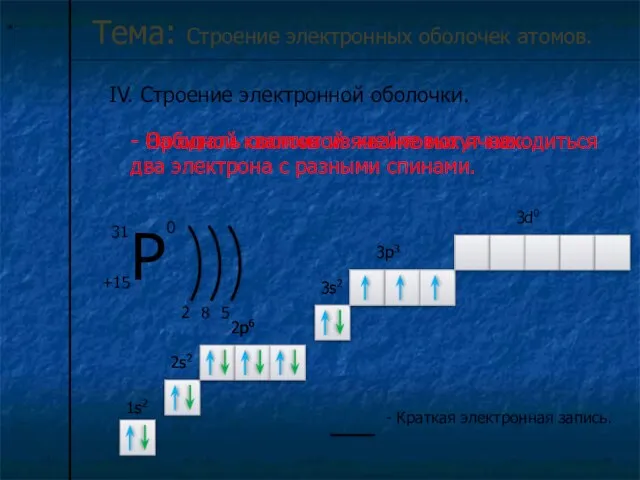
I. Электронная оболочка – это совокупность электронов, двигающихся вокруг ядра атома.
Тема:
Строение электронных оболочек атомов.
Электроны в электронной оболочке располагаются на энергетических уровнях.
n – главное квантовое число – определяет число энергетических уровней .
Номер периода совпадает с числом энергетических уровней элемента.
Период
3
Группа
V
3
Число электронов (N) на уровне рассчитывается по формуле.
N = 2n2
n = 1, N = 2 . 12 = 2
2
n = 2, N = 2 . 22 = 8
8
Номер группы совпадает с числом электронов на последнем энергетическом уровне.
5
Общее число электронов
е =
15
Проверка
15
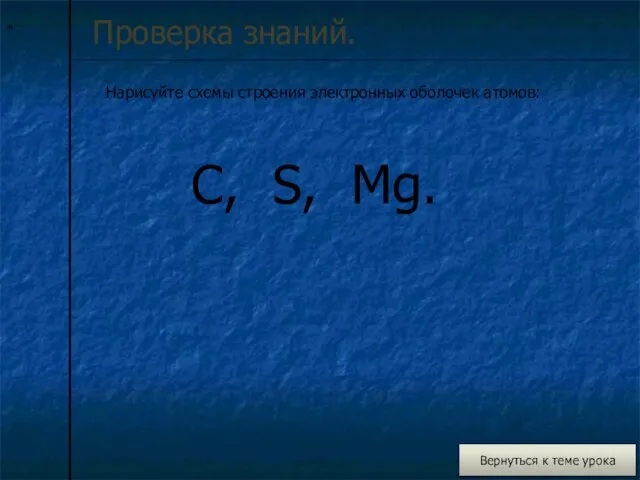
Проверка знаний
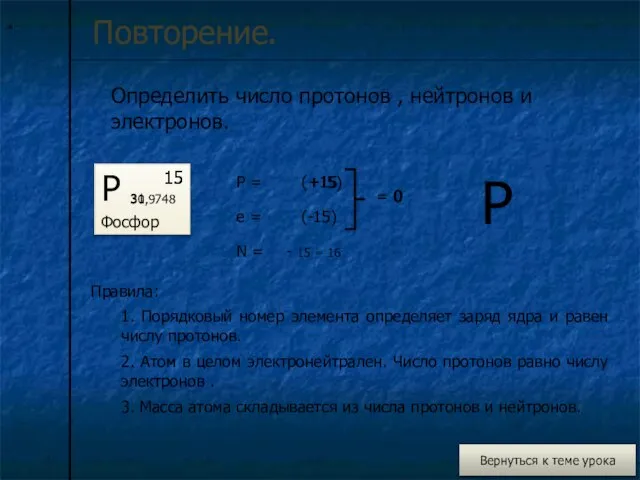
Повторение





 Стан електронів у атомі
Стан електронів у атомі Диаграмма состояния системы железо – углерод
Диаграмма состояния системы железо – углерод Нефть и способы ее переработки. (10 класс)
Нефть и способы ее переработки. (10 класс) История развития химии
История развития химии Анализ красителей и консервантов, входящих в состав безалкогольных газированных и негазированных напитков
Анализ красителей и консервантов, входящих в состав безалкогольных газированных и негазированных напитков Ионная химическая связь
Ионная химическая связь Коррозия железа
Коррозия железа EPR of phosphorus in diamond crystals. An influence of nitrogen impurity, HTHP treatment and high phosphorus concentration
EPR of phosphorus in diamond crystals. An influence of nitrogen impurity, HTHP treatment and high phosphorus concentration Бензол қатарының гетерофункционалды туындылары дәрілік заттар ретінде
Бензол қатарының гетерофункционалды туындылары дәрілік заттар ретінде Формування мотивації до самостійної пізнавальної діяльності учнів на уроках хімії
Формування мотивації до самостійної пізнавальної діяльності учнів на уроках хімії Графит кристаллическое аллотропное видоизменение углерода, в древности считалось минералом свинца
Графит кристаллическое аллотропное видоизменение углерода, в древности считалось минералом свинца Галогены. Галогеноводороды
Галогены. Галогеноводороды Будова атома. Склад атомних ядер. Ізотопи
Будова атома. Склад атомних ядер. Ізотопи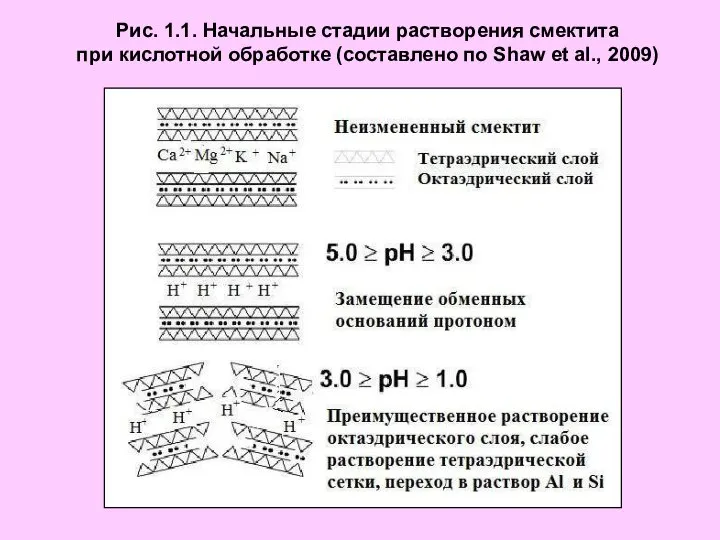 Начальные стадии растворения смектита при кислотной обработке
Начальные стадии растворения смектита при кислотной обработке Кислоты (часть 2). 8 класс
Кислоты (часть 2). 8 класс Классификация углеводов
Классификация углеводов Фотосинтез процесі
Фотосинтез процесі Пленки Лэнгмюра - Блоджетт
Пленки Лэнгмюра - Блоджетт Мына қосылыстардағы элементтердің тотығу дәрежелерін анықтаңдар
Мына қосылыстардағы элементтердің тотығу дәрежелерін анықтаңдар Ионообменная хроматография
Ионообменная хроматография Подготовка к ЕГЭ
Подготовка к ЕГЭ Нуклеин қышқылдары. ДНҚ репликациясы
Нуклеин қышқылдары. ДНҚ репликациясы Синтетические лекарственные препараты Продготовили Скорохватова Елизавета Борзова Мария 11 А
Синтетические лекарственные препараты Продготовили Скорохватова Елизавета Борзова Мария 11 А  Теория нитрования
Теория нитрования Кремний и его соединения (9 класс)
Кремний и его соединения (9 класс) Липатова Яна
Липатова Яна Презентация по Химии "Моносахариды" - скачать смотреть
Презентация по Химии "Моносахариды" - скачать смотреть  Природные источники углеводородов
Природные источники углеводородов