Содержание
- 2. В 1923г датский ученый Бренстед и английский ученый Лоури разработали протонную (протолитическую) теорию кислот и оснований,
- 3. Кислотные свойства соединений проявляются лишь в присутствии оснований, а основные свойства лишь в присутствии кислот. От
- 4. Кислота, отдавая Н+, превращается в основание, которое называется сопряженным. Н+ СН3СООН + Н2О ↔ СН3СОО- +
- 5. Три типа кислот и оснований: Нейтральные: кислоты (HCl, H2SO4, H3PO4) основания (NH3, H2O, C2H5OH) Катионные: кислоты
- 6. Типы протолитических реакций: Автопротолиз, сольволиз (самоионизация) Н2О + Н2О ↔ ОН- + Н3О+ к о с.о.
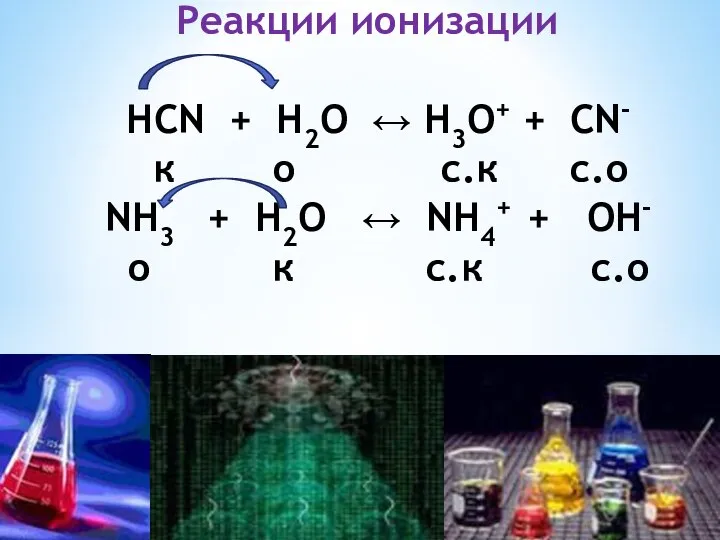
- 7. Реакции ионизации НСN + Н2О ↔ Н3О+ + СN- к о с.к с.о NH3 + Н2О
- 8. Реакции нейтрализации ОН- + Н3О+↔ Н2O + Н2O о к с.к с.о Реакции гидролиза: NH4+ +
- 9. Протолитические кислотно-основные равновесия могут иметь место не только в Н2O, но и в других растворителях, например
- 10. Поэтому более общей является электронная теория кислот и оснований Льюиса, согласно которой: Кислота - вещество, принимающее
- 11. Н \ Н \ Н - N: + НCI → Н - N : НCI Н
- 12. К основанием Льюиса относятся CI-; NH3; амины, кислородсодержащие органические соединения R2CO. К кислотам Льюиса: галогениды бора,
- 13. Ионизация воды. Водородный и гидроксильный показатели. Константа автопротолиза. Вода ведет себя как амфолит, согласно теории Бренстера-Лоури
- 14. Возьмем 1кг (л) воды [Н2O]=1000г/18г/моль=55,5моль/л К(Н2O) = 1,86 ⋅10-16 ⋅ 55,5=1·10-14 В чистой воде [Н3О+] =
- 15. Для удобства расчетов используют значение: рН = - lg[Н3О+] - водородный показатель рОН= - lg[ОН-]-гидроксильный показатель
- 16. Расчет рН сильных электролитов. В растворах сильных электролитов рН кислот и оснований зависит от концентрации кислоты
- 17. В растворах слабых кислот: НА ↔ Н+ + А- или НА + Н2О ↔ А- +
- 18. Расчет рН слабых оснований: В + Н2О ↔ ВН+ + ОН- рОН = 1/2рК(В)- 1/2lgC(1/z В)
- 19. БУФЕРНЫЕ СИСТЕМЫ Буферные системы - это равновесные системы, способные сохранять постоянное значение рН при добавлении к
- 20. Например, буферные смеси при молярном соотношении 1:1. НСООН + НСООNa формиатная, рН=3,8 СН3СООН + СН3СООNa ацетатная,
- 21. К буферам 2 типа относятся протолитические системы слабых оснований и их солей с сильными кислотами. Например,
- 22. Способность буферных систем поддерживать постоянство рН при добавлении к ним небольших количеств сильной кислоты или сильного
- 23. МЕХАНИЗМ ДЕЙСТВИЯ БУФЕРНЫХ СИСТЕМ Например: если к ацетатной буферной системе прилить сильную кислоту (НCl;Н2SО4), то произойдет
- 24. При добавлении к ацетатной буферной смеси сильной щелочи (NaОН; КОН) пойдет реакция нейтрализации уксусной кислоты сильным
- 32. БУФЕРНЫЕ СИСТЕМЫ ОРГАНИЗМА Основная функция буферных систем - предотвращение значительных сдвигов рН путём взаимодействия буфера как
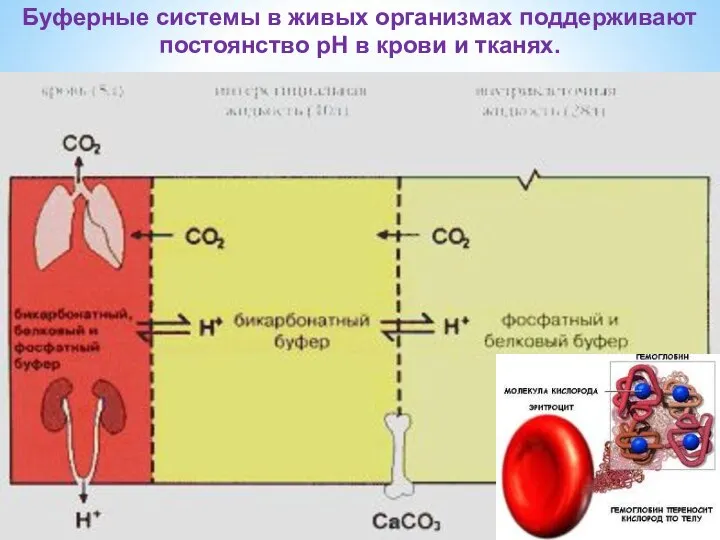
- 33. Буферные системы в живых организмах поддерживают постоянство рН в крови и тканях.
- 34. В организме человека за сутки образуется такое количество различных кислот, которое эквивалентно 2,0 - 3,0 литрам
- 35. Алкалоз - при кишечной непроходимости, рвоте, лихорадке. Для коррекции кислотно-основного равновесия при ацидозах назначают 4 %
- 37. Скачать презентацию











![Возьмем 1кг (л) воды [Н2O]=1000г/18г/моль=55,5моль/л К(Н2O) = 1,86 ⋅10-16 ⋅ 55,5=1·10-14](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1397649/slide-13.jpg)
![Для удобства расчетов используют значение: рН = - lg[Н3О+] - водородный](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1397649/slide-14.jpg)



















 Органічні речовини як основа сучасних матеріалів. Пластмаси, синтетичні каучуки, гума, штучні й синтетичні волокна Підготувал
Органічні речовини як основа сучасних матеріалів. Пластмаси, синтетичні каучуки, гума, штучні й синтетичні волокна Підготувал Ученица 10 «А» класса Ахметгалеева Алина МБОУ «Гимназия» Сабинского района п.г.т. Б.Сабы
Ученица 10 «А» класса Ахметгалеева Алина МБОУ «Гимназия» Сабинского района п.г.т. Б.Сабы Классификация органических соединений. (10 класс)
Классификация органических соединений. (10 класс) Оксиды, их применение
Оксиды, их применение Презентация Коррозия
Презентация Коррозия Отчет по ПП.03.01 «Лаборант химического анализа»
Отчет по ПП.03.01 «Лаборант химического анализа» Вещества и материалы. Классификация веществ. Индикаторы. 6 класс
Вещества и материалы. Классификация веществ. Индикаторы. 6 класс Химические свойства металлов Урок химии в 11 классе
Химические свойства металлов Урок химии в 11 классе Нуклеиновые кислоты
Нуклеиновые кислоты Пластмаса
Пластмаса  Химически опасные объекты (ХОО)
Химически опасные объекты (ХОО) Строение вещества
Строение вещества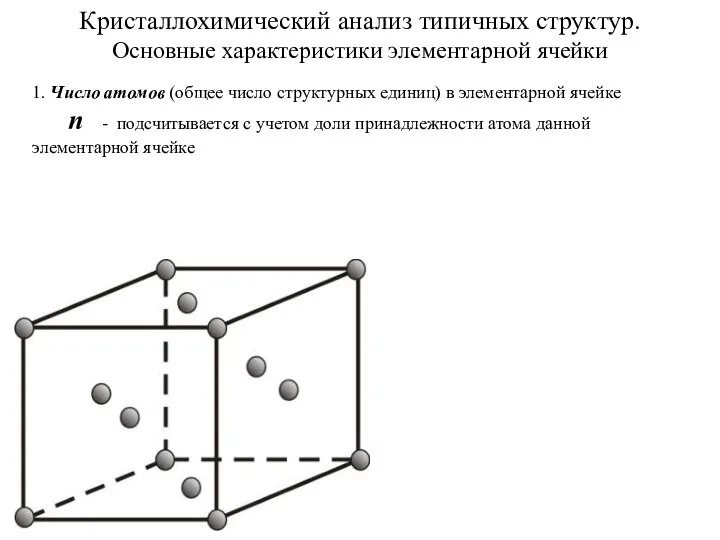 Кристаллохимический анализ типичных структур. Основные характеристики элементарной ячейки
Кристаллохимический анализ типичных структур. Основные характеристики элементарной ячейки Произведение растворимости. Строение комплексных, координационных соединений. Устойчивость в растворах
Произведение растворимости. Строение комплексных, координационных соединений. Устойчивость в растворах Титриметриялық анализ. Жіктелуі. Қышқылдықнегіздік титрлеу. Алкалиметрия және ацидометрия. Реакцияларға қойылатын талаптар
Титриметриялық анализ. Жіктелуі. Қышқылдықнегіздік титрлеу. Алкалиметрия және ацидометрия. Реакцияларға қойылатын талаптар Промахи, q-критерий. Сравнение воспроизводимости двух серий данных. Сравнение двух средних
Промахи, q-критерий. Сравнение воспроизводимости двух серий данных. Сравнение двух средних Окисно-відновні реакції, процеси окиснення і відновлення, окисники і відновники
Окисно-відновні реакції, процеси окиснення і відновлення, окисники і відновники Общие электронные конфигурации элементов главных подгрупп
Общие электронные конфигурации элементов главных подгрупп Электролитическая диссоциация
Электролитическая диссоциация Негізгі топша элементтерінің химиясы
Негізгі топша элементтерінің химиясы Cинтетичні миючі засоби і їхній вплив на людину
Cинтетичні миючі засоби і їхній вплив на людину  Алюминий и его соединения
Алюминий и его соединения Химические свойства и применение кислорода
Химические свойства и применение кислорода Лактоза
Лактоза Алканы (структурная изомерия и систематическая номенклатура)
Алканы (структурная изомерия и систематическая номенклатура)
 Полисульфидные каучуки
Полисульфидные каучуки Третья группа ПС
Третья группа ПС