Содержание
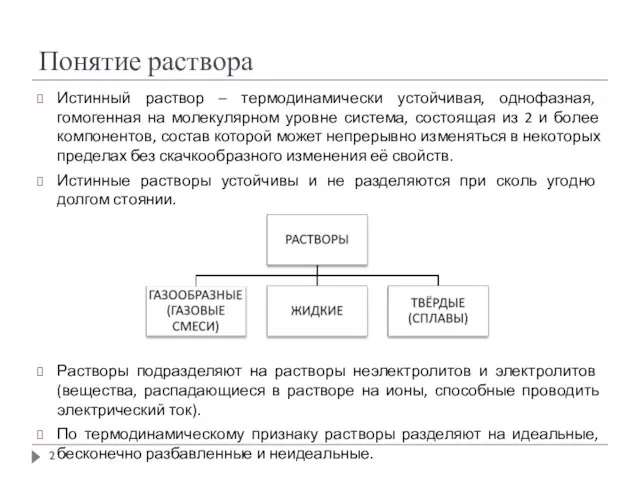
- 2. Понятие раствора Истинный раствор – термодинамически устойчивая, однофазная, гомогенная на молекулярном уровне система, состоящая из 2
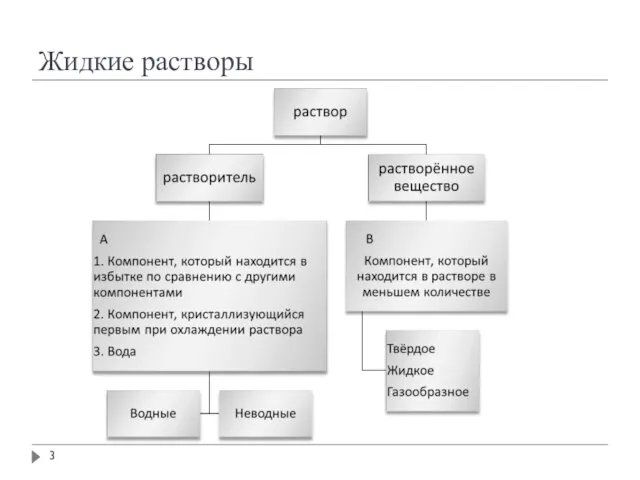
- 3. Жидкие растворы
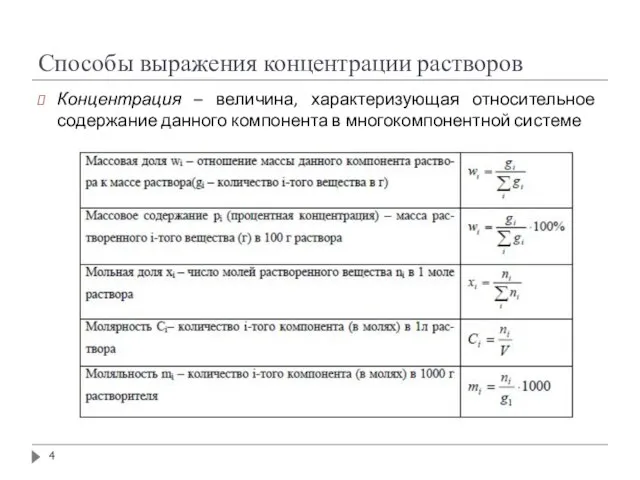
- 4. Способы выражения концентрации растворов Концентрация – величина, характеризующая относительное содержание данного компонента в многокомпонентной системе
- 5. Способы выражения концентрации растворов
- 6. Парциальные мольные величины Парциальными мольными величинами могут быть V, H, S, Cp, G, F.
- 7. Парциальные мольные величины
- 8. Парциальные мольные величины
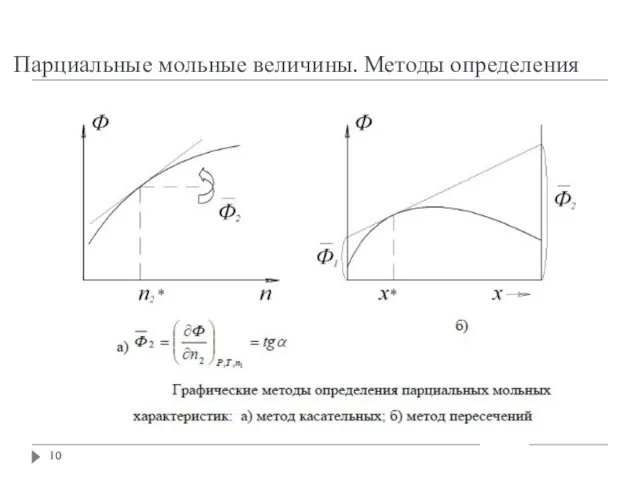
- 9. Парциальные мольные величины. Методы определения
- 10. Парциальные мольные величины. Методы определения
- 11. Образование растворов
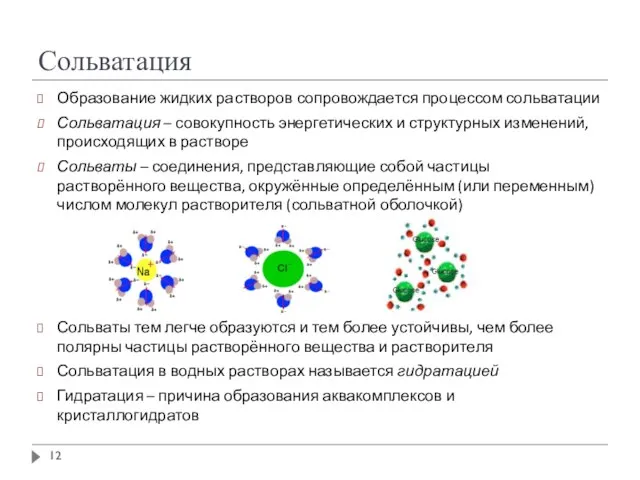
- 12. Сольватация Образование жидких растворов сопровождается процессом сольватации Сольватация – совокупность энергетических и структурных изменений, происходящих в
- 13. Движущая сила образования растворов Энтропийный и энтальпийный факторы - При растворении газов в жидкости энтропия всегда
- 14. Движущая сила образования растворов Независимо от знака энтальпии при растворении всегда т.е. переход вещества в раствор
- 15. Растворимость Процесс растворения протекает самопроизвольно до тех пор, пока химический потенциал чистого компонента превышает химический потенциал
- 16. Растворимость газов в газах. Закон Дальтона
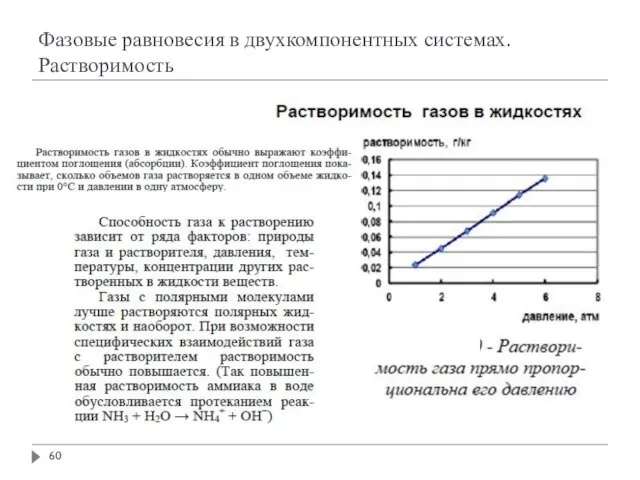
- 17. Растворимость газов в жидкостях. Закон Генри
- 18. Растворимость смеси газов в жидкостях
- 19. Растворимость газов в жидкостях
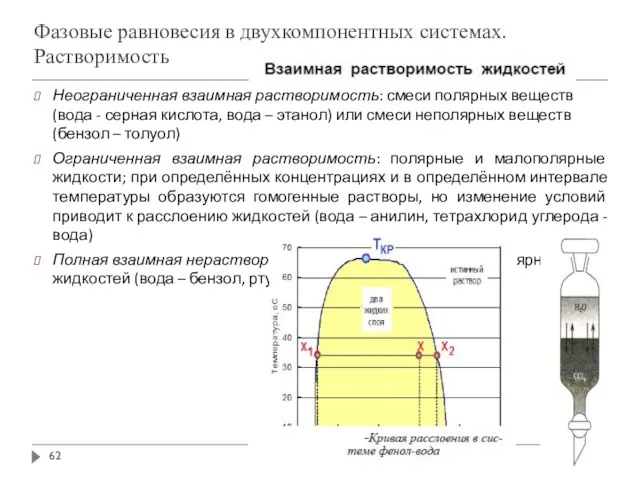
- 20. Взаимная растворимость жидкостей Неограниченная взаимная растворимость: смеси полярных веществ (вода - серная кислота, вода – этанол)
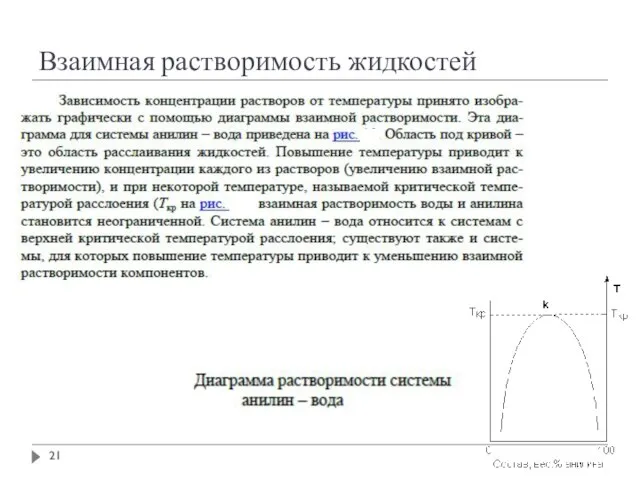
- 21. Взаимная растворимость жидкостей
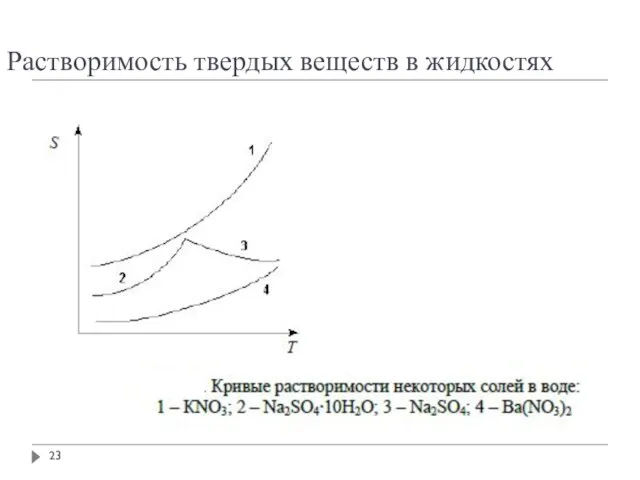
- 22. Растворимость твердых веществ в жидкостях
- 23. Растворимость твердых веществ в жидкостях
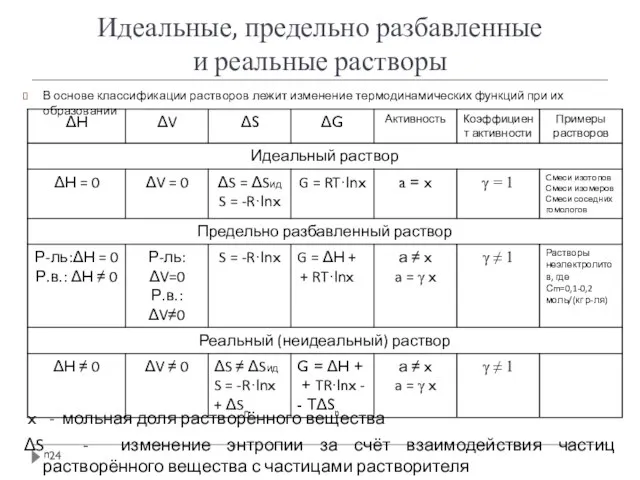
- 24. Идеальные, предельно разбавленные и реальные растворы В основе классификации растворов лежит изменение термодинамических функций при их
- 25. Идеальные растворы Идеальным называется раствор, для которого соблюдается аддитивность парциальных давлений, парциальных объёмов, теплоёмкостей и энтальпий
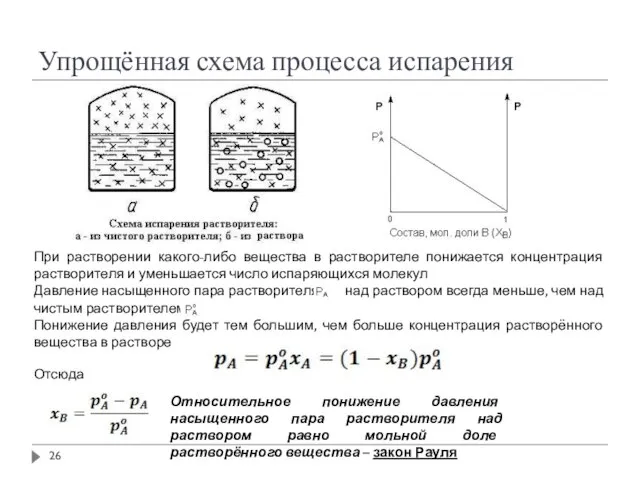
- 26. Упрощённая схема процесса испарения При растворении какого-либо вещества в растворителе понижается концентрация растворителя и уменьшается число
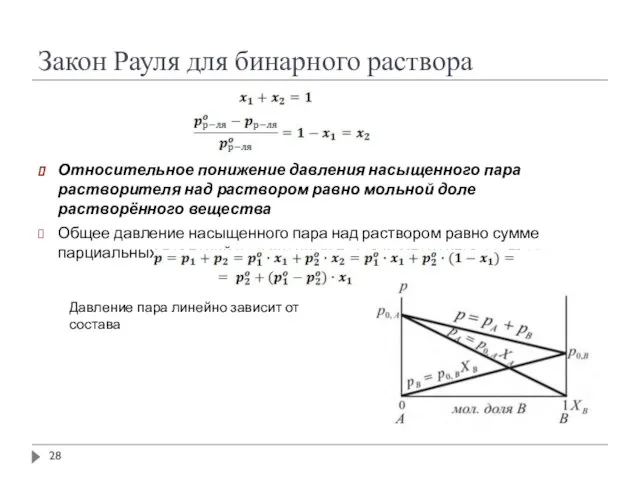
- 27. Закон Рауля Парциальное давление насыщенного пара компонента раствора над раствором рi прямо пропорционально мольной доле этого
- 28. Закон Рауля для бинарного раствора Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле
- 29. Предельно разбавленные растворы Предельно разбавленным называют раствор, в котором концентрация растворённого вещества бесконечно мала ( )
- 30. Реальные (неидеальные) растворы Неидеальными называют растворы, которые не подчиняются термодинамическим закономерностям идеальных и предельно разбавленных растворов.
- 31. Коэффициент активности Активность выражается в виде произведения мольной доли компонента xi на его коэффициент активности γi
- 32. Регулярные и атермальные растворы Для регулярных растворов энтропия смешения совпадает с энтропией смешения идеального раствора ΔS
- 33. Коллигативные свойства разбавленных растворов Коллигативными называются свойства растворов, зависящие только от концентрации, но не от природы,
- 34. Коллигативные свойства разбавленных растворов Повышение температуры начала кипения раствора Если парообразование происходит не только со свободной
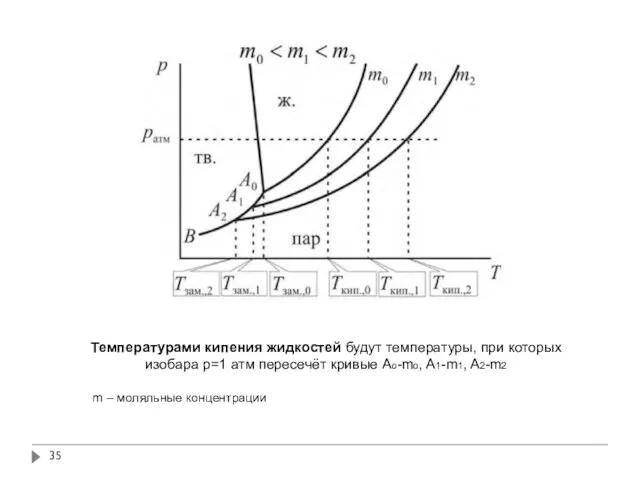
- 35. Температурами кипения жидкостей будут температуры, при которых изобара р=1 атм пересечёт кривые Ao-mo, A1-m1, A2-m2 m
- 36. Коллигативные свойства разбавленных растворов Повышение температуры начала кипения раствора Для идеальных растворов Для предельно разбавленных растворов
- 37. Повышение температуры кипения разбавленного раствора нелетучего вещества прямо пропорционально моляльной концентрации раствора и не зависит от
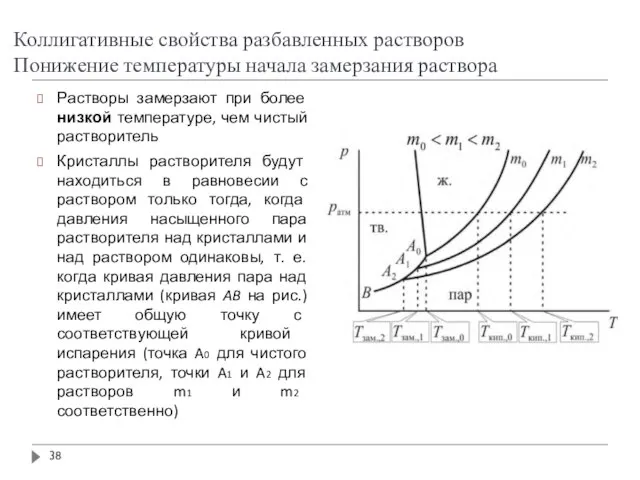
- 38. Коллигативные свойства разбавленных растворов Понижение температуры начала замерзания раствора Растворы замерзают при более низкой температуре, чем
- 39. Для идеальных растворов Для предельно разбавленных растворов Тзам – температура замерзания раствора - энтальпия плавления растворителя
- 40. Понижение температуры замерзания разбавленного раствора нелетучего вещества прямо пропорционально моляльной концентрации раствора и не зависит от
- 41. Так как коллигативные свойства растворов зависят от числа растворённых частиц (концентрации), то это позволяет определять с
- 42. Для неидеальных растворов для расчёта понижения температуры начала замерзания и повышения температуры начала кипения в соответствующие
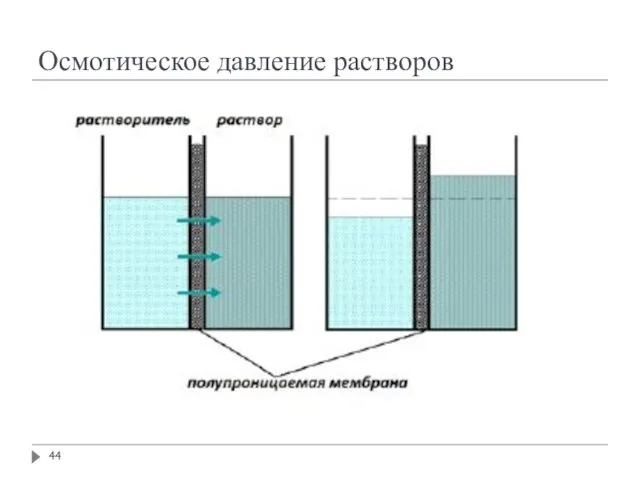
- 43. Осмотическое давление растворов Осмос – диффузия вещества, обычно растворителя, через полупроницаемую мембрану, разделяющую раствор и чистый
- 44. Осмотическое давление растворов
- 45. Осмотическое давление растворов Осмотическое давление равно тому газовому давлению, которым обладало бы растворённое вещество, если бы
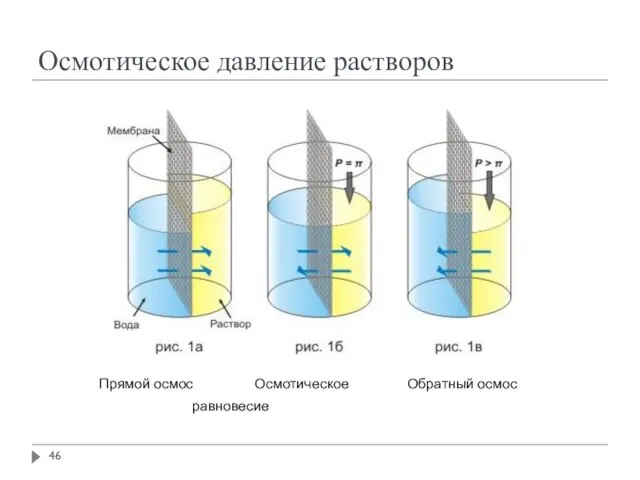
- 46. Прямой осмос Осмотическое Обратный осмос равновесие Осмотическое давление растворов
- 47. Осмотическое давление растворов В разбавленных растворах осмотическое давление вычисляется по закону осмотического давления Вант-Гоффа: Из уравнения
- 48. Расчёт молярной массы Измерив осмотическое давление для раствора какого-либо вещества, можно рассчитать его молярную концентрацию, а
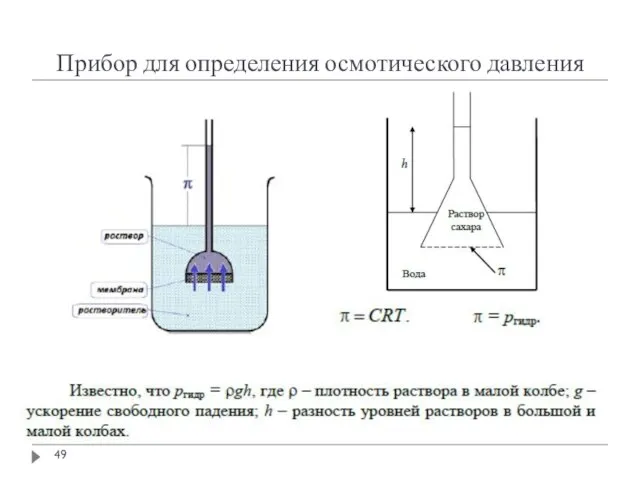
- 49. Прибор для определения осмотического давления
- 50. Коллигативные свойства растворов электролитов Изотонический коэффициент
- 51. Распределение растворённого вещества между двумя несмешивающимися растворителями Если какое-либо вещество растворимо в двух несмешивающихся жидкостях, то
- 52. Рассмотрим распределение иода между двумя несмешивающимися растворителями - водой и тетрахлорметаном Если встряхивать иод с этими
- 53. При 25°С значение постоянной К для рассматриваемого равновесия равно 85. Это означает, что концентрация иода в
- 54. Экстракция Экстракция – извлечение растворённого вещества из раствора при помощи другого растворителя (экстрагента), практически не смешивающегося
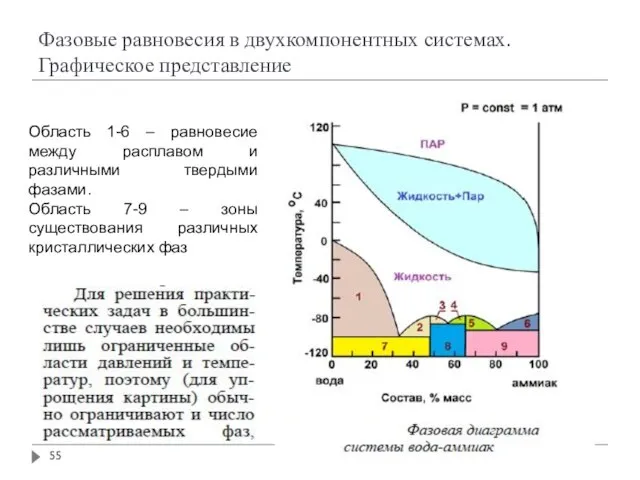
- 55. Фазовые равновесия в двухкомпонентных системах. Графическое представление Область 1-6 – равновесие между расплавом и различными твердыми
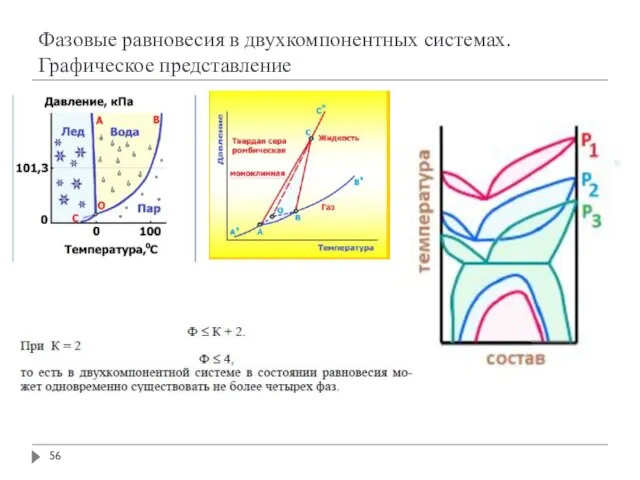
- 56. Фазовые равновесия в двухкомпонентных системах. Графическое представление
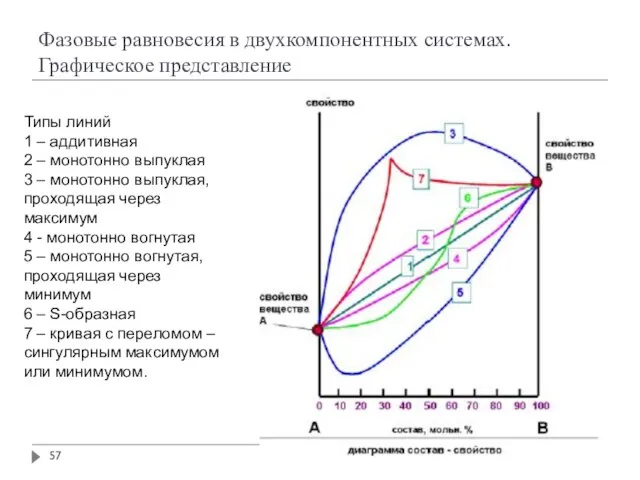
- 57. Фазовые равновесия в двухкомпонентных системах. Графическое представление Типы линий 1 – аддитивная 2 – монотонно выпуклая
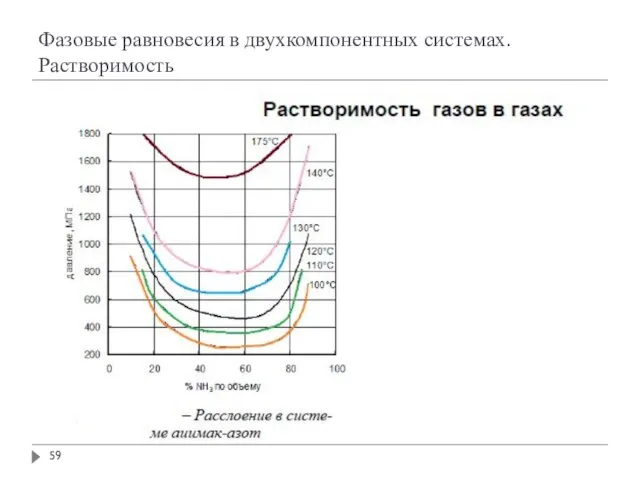
- 58. Фазовые равновесия в двухкомпонентных системах. Растворимость
- 59. Фазовые равновесия в двухкомпонентных системах. Растворимость
- 60. Фазовые равновесия в двухкомпонентных системах. Растворимость
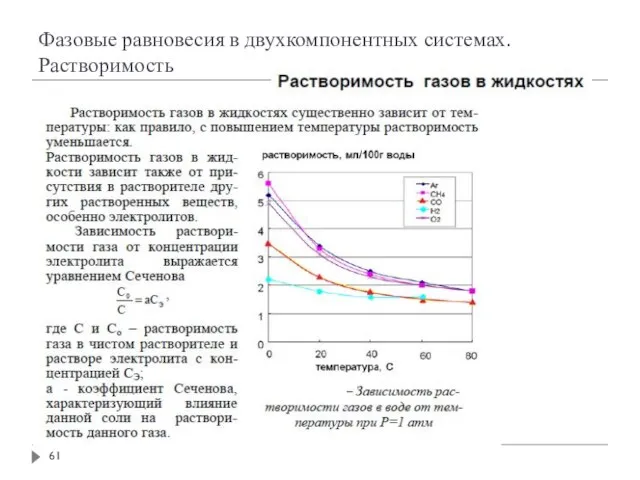
- 61. Фазовые равновесия в двухкомпонентных системах. Растворимость
- 62. Неограниченная взаимная растворимость: смеси полярных веществ (вода - серная кислота, вода – этанол) или смеси неполярных
- 63. Растворимость твёрдых веществ Растворимостью твёрдого вещества в жидкости называется концентрация насыщенного раствора, находящегося в равновесии с
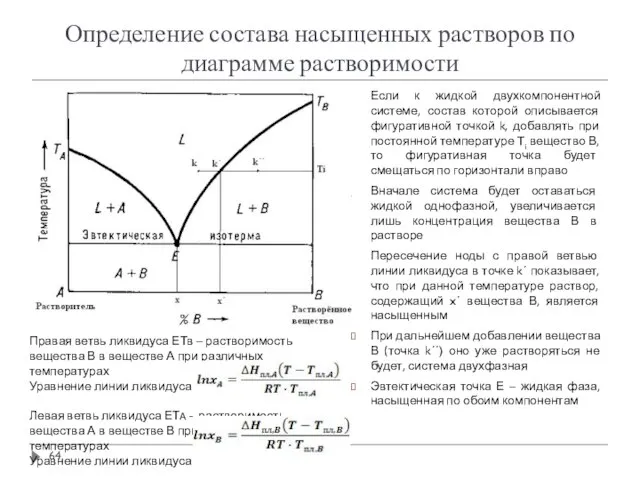
- 64. Определение состава насыщенных растворов по диаграмме растворимости Если к жидкой двухкомпонентной системе, состав которой описывается фигуративной
- 65. Выводы из уравнения Шредера Так как ΔНпл > 0, то растворимость твёрдых веществ в жидкости увеличивается
- 66. Давление пара летучих смесей Летучим жидким веществом называют жидкость, которая при данной температуре имеет высокое давление
- 67. Упрощённая схема процесса испарения При растворении какого-либо вещества в растворителе понижается концентрация растворителя и уменьшается число
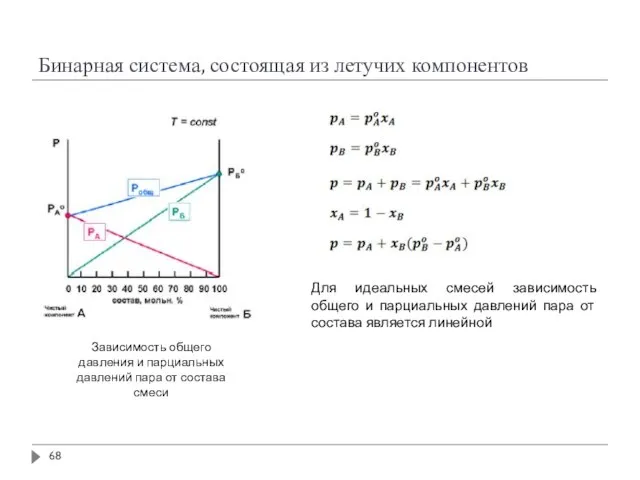
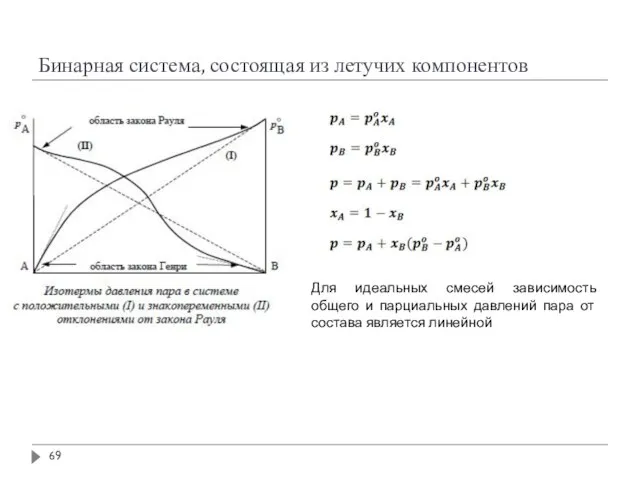
- 68. Бинарная система, состоящая из летучих компонентов Для идеальных смесей зависимость общего и парциальных давлений пара от
- 69. Бинарная система, состоящая из летучих компонентов Для идеальных смесей зависимость общего и парциальных давлений пара от
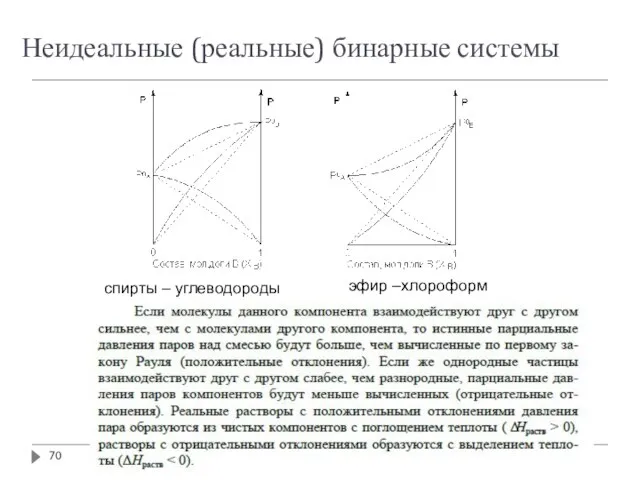
- 70. Неидеальные (реальные) бинарные системы эфир –хлороформ спирты – углеводороды
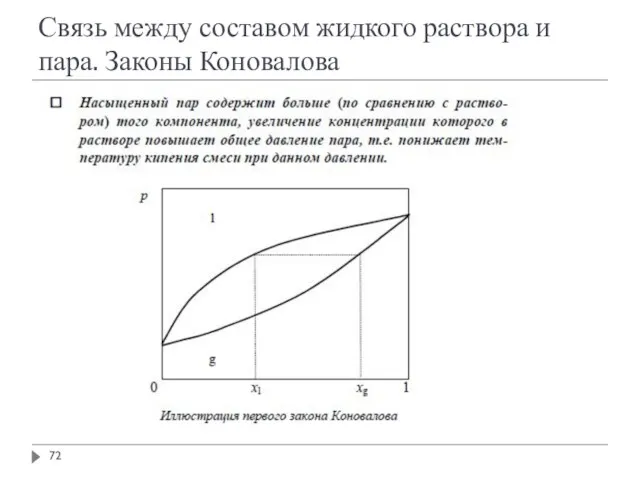
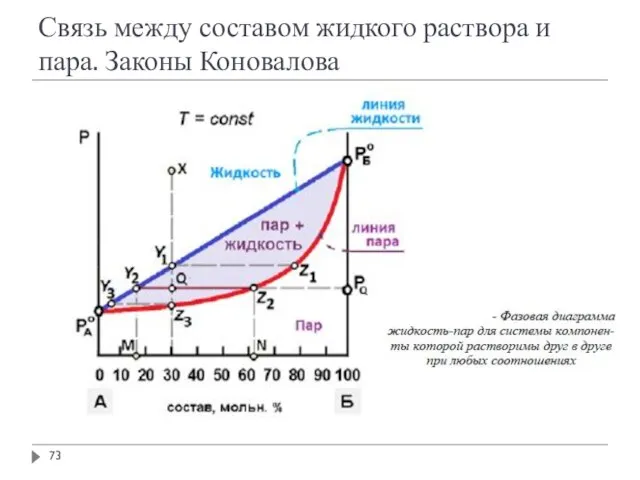
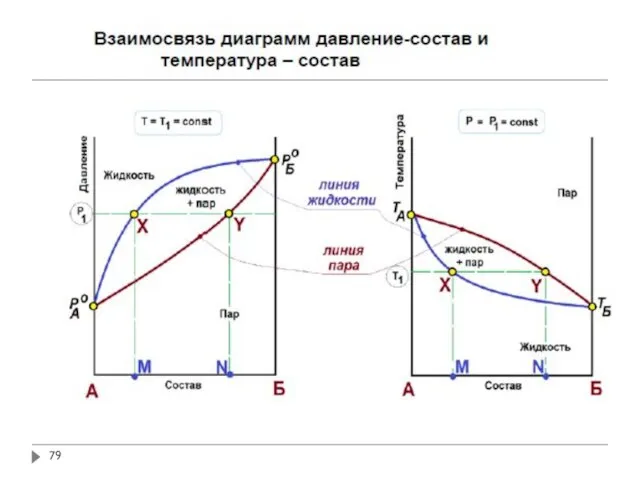
- 71. Связь между составом жидкого раствора и пара. Законы Коновалова
- 72. Связь между составом жидкого раствора и пара. Законы Коновалова
- 73. Связь между составом жидкого раствора и пара. Законы Коновалова
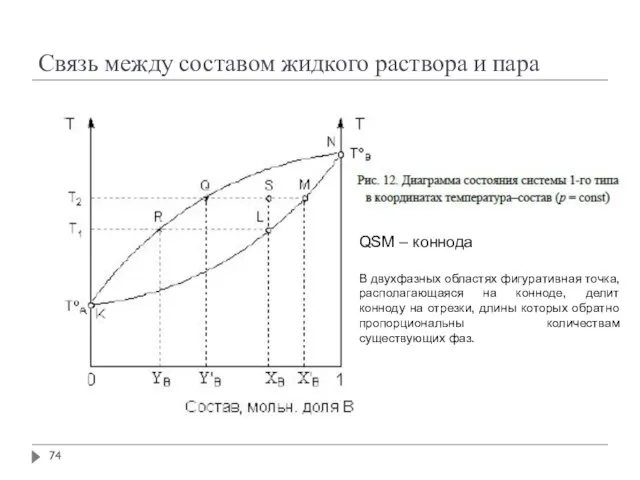
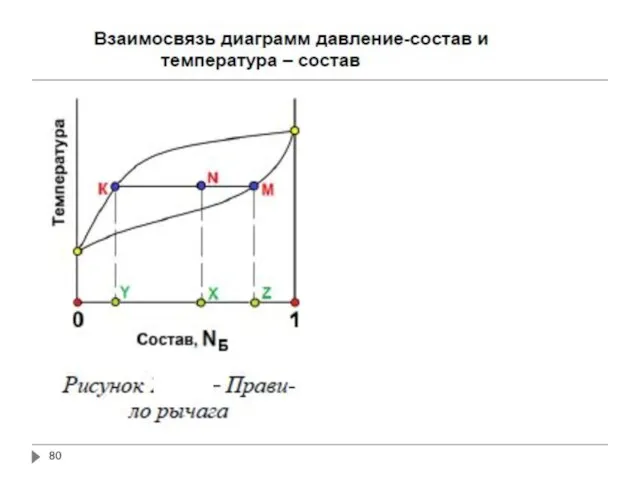
- 74. Связь между составом жидкого раствора и пара QSM – коннода В двухфазных областях фигуративная точка, располагающаяся
- 75. Связь между составом жидкого раствора и пара
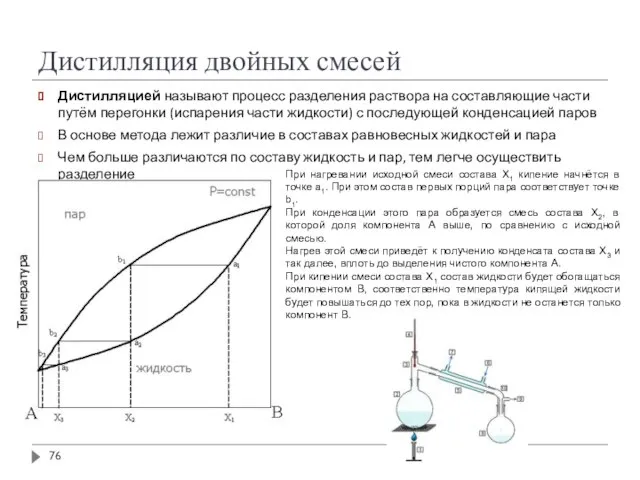
- 76. Дистилляция двойных смесей Дистилляцией называют процесс разделения раствора на составляющие части путём перегонки (испарения части жидкости)
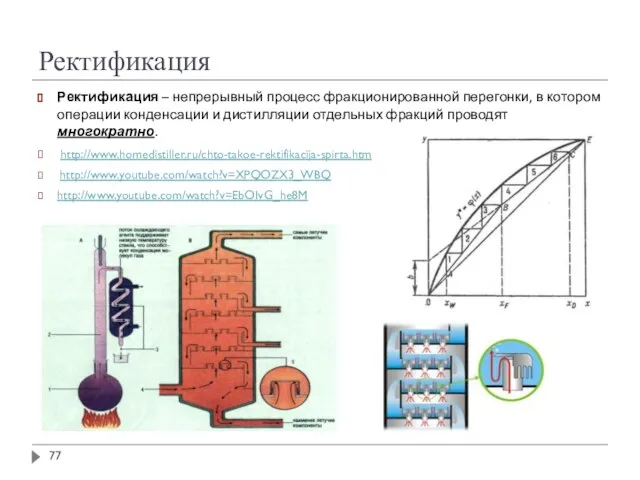
- 77. Ректификация Ректификация – непрерывный процесс фракционированной перегонки, в котором операции конденсации и дистилляции отдельных фракций проводят
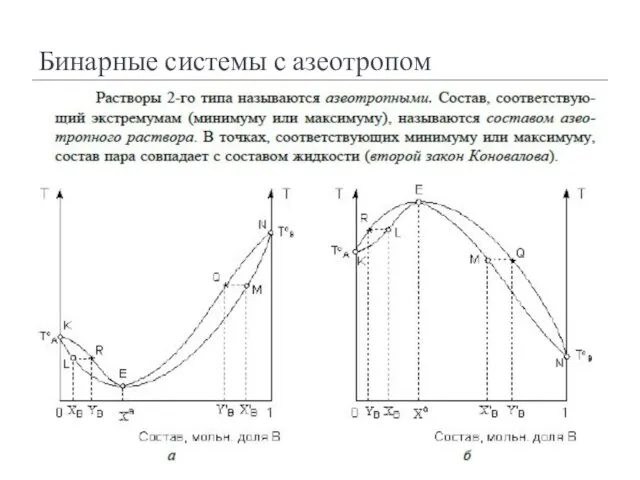
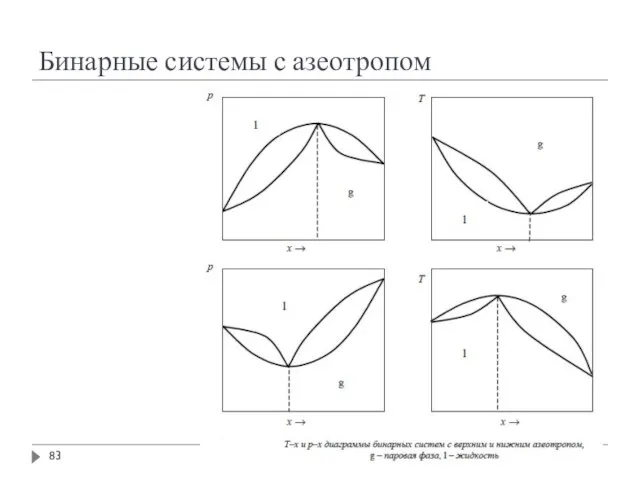
- 82. Бинарные системы с азеотропом
- 83. Бинарные системы с азеотропом
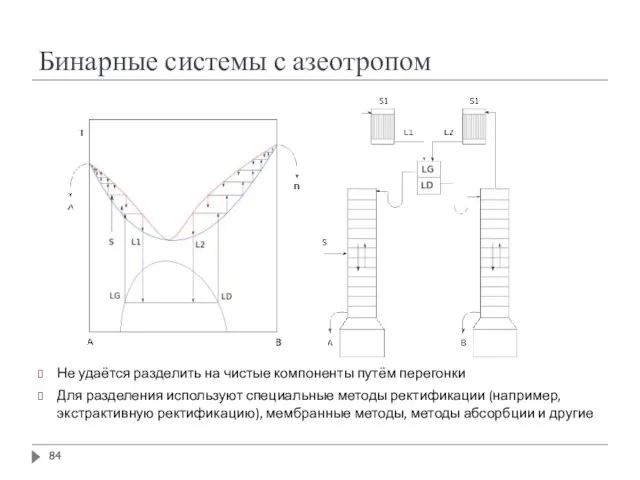
- 84. Бинарные системы с азеотропом Не удаётся разделить на чистые компоненты путём перегонки Для разделения используют специальные
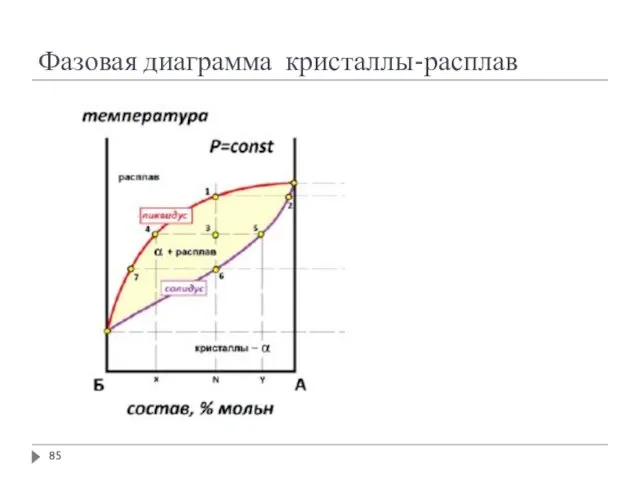
- 85. Фазовая диаграмма кристаллы-расплав
- 87. Скачать презентацию














































 Химическая промышленность
Химическая промышленность Электоролиз заңы
Электоролиз заңы Нефть — это жидкое горючее полезное ископаемое
Нефть — это жидкое горючее полезное ископаемое Процессы формирования водородной плазмы в зоне резания
Процессы формирования водородной плазмы в зоне резания Калій. Знаходження в періодичній системі і основні характеристики
Калій. Знаходження в періодичній системі і основні характеристики Вирощування кристалів солей
Вирощування кристалів солей Водород
Водород Гравиметриялық анализдеу әдістері
Гравиметриялық анализдеу әдістері Презентация по Химии "Природные запасы углеводородов Уголь" - скачать смотреть
Презентация по Химии "Природные запасы углеводородов Уголь" - скачать смотреть  Биохимия печени
Биохимия печени Содержание химических элементов в организме. Макро- и микроэлементы
Содержание химических элементов в организме. Макро- и микроэлементы Металдардың тұздармен реакциялары
Металдардың тұздармен реакциялары Может ли вода приносить вред здоровью? Авторы: Козлова Ирина Владимировна, Ушакова Кристина Николаевна, 9 класс МОУ «СОШ №12», г. А
Может ли вода приносить вред здоровью? Авторы: Козлова Ирина Владимировна, Ушакова Кристина Николаевна, 9 класс МОУ «СОШ №12», г. А Применение карбоновых кислот и сложных эфиров
Применение карбоновых кислот и сложных эфиров Гормондар биохимиясы. Гормондар және бейімділік процестер
Гормондар биохимиясы. Гормондар және бейімділік процестер Три правила взаимодействия элементов симметрии
Три правила взаимодействия элементов симметрии Метанол: получение и применение
Метанол: получение и применение Бор и его соединения
Бор и его соединения Применение уксусной кислоты
Применение уксусной кислоты Карбон Колообіг в природі
Карбон Колообіг в природі  Фотохимические превращения ДНК. Люминесцентные метки и зонды и их применение в биологии и медицине
Фотохимические превращения ДНК. Люминесцентные метки и зонды и их применение в биологии и медицине Кислотно-основное титрование
Кислотно-основное титрование Целлюлоза
Целлюлоза Растворы. Классификация дисперсных систем
Растворы. Классификация дисперсных систем Соли азотной кислоты
Соли азотной кислоты Тема: Мониторинг воды и осадков в разное время года. Творческое название проекта: «Пить или не пить - вот в чем вопрос» Авторы:Коньк
Тема: Мониторинг воды и осадков в разное время года. Творческое название проекта: «Пить или не пить - вот в чем вопрос» Авторы:Коньк Синтетические волокна
Синтетические волокна  Аттестационная работа: Сравнение показателей качества меда разных производителей
Аттестационная работа: Сравнение показателей качества меда разных производителей