Содержание
- 2. Иодометрия Титрант – тиосульфат натрия Na2S2O3 Титруемое вещество – I2 I2 + 2Na2S2O3 = 2NaI +
- 3. Ox + 2I- → Red + I2 (выделившийся в эквивалентном окислителю количестве иод оттитровывают стандартным раствором
- 4. Иодометрическое титрование проводится при 5 ≤ рН ≤ 7, т.к. кислой среде тиосульфат разлагается: S2O32- +
- 5. Приготовление и стандартизация тиосульфата натрия Раствор тиосульфата натрия готовят на свежепрокипяченой воде 2Na2S2O3 + O2 →
- 6. Примеры практического применения иодометрии Восстановители (SO32-; S2-) ( обратное титрование) SO32-+ I2(изб) + H2O → SO42-+
- 7. 2. Окислители (K2Cr2O7 ; Cu2+ ) ( титрование заместителя ) 2CuSO4 + 4KI = 2CuI +
- 8. 4. Вещества, не обладающие окислительно-восстановительными свойствами (Pb2+ ; Ba2+ ) Способ обратного титрования 2Pb2+ + Cr2O72-
- 9. Способ титрования заместителя 2Pb CrO42- + 2Н+ = Cr2O72- + 2Pb2+ + H2O Cr2O72- + 6
- 10. 5. Органические соединения (формальдегид) Способ обратного титрования HCOH + I2(изб) + 3OH- = HCOO- + 2I-
- 12. Скачать презентацию









 Кислотно-основное титрование. 4 лекция. Часть 2
Кислотно-основное титрование. 4 лекция. Часть 2 Дослідження складу засобів гігієни та їх вплив на здоров’я людини Підготував : Учень 11 класу СШІТ № 2 Циб Владислав
Дослідження складу засобів гігієни та їх вплив на здоров’я людини Підготував : Учень 11 класу СШІТ № 2 Циб Владислав  Закон сохранения массы веществ
Закон сохранения массы веществ ОЧКАСОВ ЕВГЕНИЙ МИХАЙЛОВИЧ ПРЕПОДАВАТЕЛЬ ХИМИИ И БИОЛОГИИ ГОСУДАРСТВЕННОГО АВТОНОМНОГО ОБРАЗОВАТЕЛЬНОГО УЧРЕЖДЕНИЯ СРЕДНЕГО
ОЧКАСОВ ЕВГЕНИЙ МИХАЙЛОВИЧ ПРЕПОДАВАТЕЛЬ ХИМИИ И БИОЛОГИИ ГОСУДАРСТВЕННОГО АВТОНОМНОГО ОБРАЗОВАТЕЛЬНОГО УЧРЕЖДЕНИЯ СРЕДНЕГО Взаимодействие в двухкомпонентных системах. Примитивные виды взаимодействия: без промежуточных фаз
Взаимодействие в двухкомпонентных системах. Примитивные виды взаимодействия: без промежуточных фаз Электрохимические процессы и явления
Электрохимические процессы и явления Диазины. Характеристика диазинов. (Лекция 8)
Диазины. Характеристика диазинов. (Лекция 8) Полиэтилен, свойства и применение
Полиэтилен, свойства и применение Когда его называли гением, он морщился: "Какой там гений. Трудился всю жизнь, вот и стал гением". Когда в 26 лет писал курс "
Когда его называли гением, он морщился: "Какой там гений. Трудился всю жизнь, вот и стал гением". Когда в 26 лет писал курс " Термодинамика. 2 закон термодинамики. Энтропия
Термодинамика. 2 закон термодинамики. Энтропия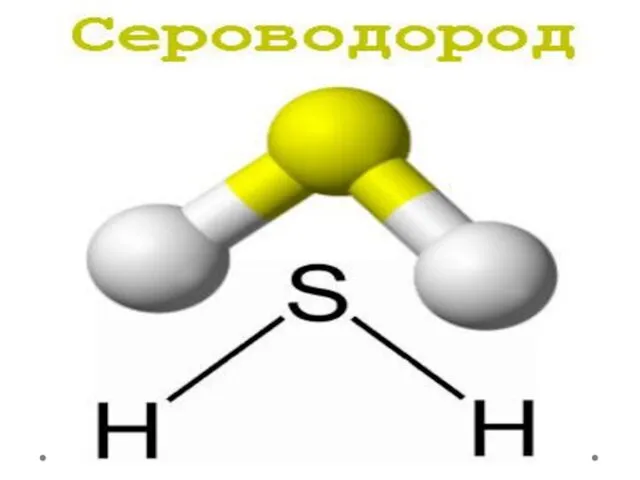 Сероводород. Физические и химические свойства
Сероводород. Физические и химические свойства Химики на службе у дорог
Химики на службе у дорог Общие сведения о месторождениях полезных ископаемых
Общие сведения о месторождениях полезных ископаемых ПОЛИЭТИЛЕН
ПОЛИЭТИЛЕН  Презентация Предельные углеводороды
Презентация Предельные углеводороды  Силоксановый каучук
Силоксановый каучук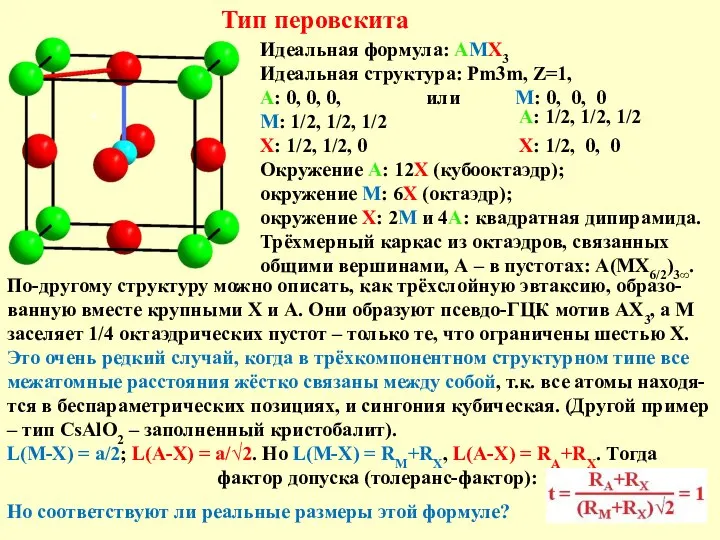 Тип перовскита
Тип перовскита Природный и синтетический каучуки. Резина
Природный и синтетический каучуки. Резина Газообразное состояние вещества Шаманина Наталья Сергеевна учитель химии, экологии и географии БОУ г. Омска «Средняя общеобраз
Газообразное состояние вещества Шаманина Наталья Сергеевна учитель химии, экологии и географии БОУ г. Омска «Средняя общеобраз Относительная атомная и молекулярная массы
Относительная атомная и молекулярная массы Темір. Жалпы сипаттама. Периодтық жүйедегі орны және атом құрылысы
Темір. Жалпы сипаттама. Периодтық жүйедегі орны және атом құрылысы Спирты. Понятие о спиртах
Спирты. Понятие о спиртах Предельные углеводороды. Насыщенные алифатические углеводороды. Алканы или Парафины
Предельные углеводороды. Насыщенные алифатические углеводороды. Алканы или Парафины Химиялық реакция жылдамдығы
Химиялық реакция жылдамдығы Презентация по Химии "Рисуем овощи и фрукты" - скачать смотреть бесплатно
Презентация по Химии "Рисуем овощи и фрукты" - скачать смотреть бесплатно Презентация по Химии "Презентация Йод" - скачать смотреть
Презентация по Химии "Презентация Йод" - скачать смотреть  Изотопы. Химические и физические свойства
Изотопы. Химические и физические свойства Токсикология и анализ спиртов
Токсикология и анализ спиртов