Содержание
- 3. Химический знак - S Порядковый номер – 16 Аr - 32.066 Период - III Группа –
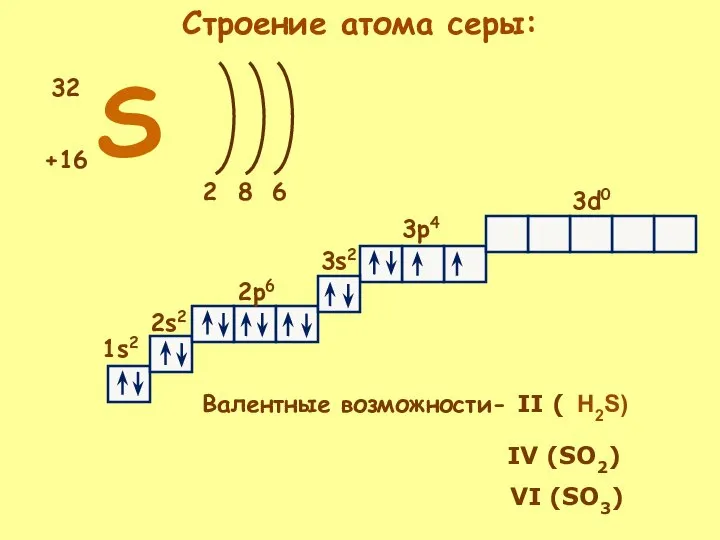
- 4. S +16 32 2 6 8 1s2 2s2 2p6 3s2 3p4 3d0 Валентные возможности- II (
- 5. Нахождение серы в природе. Самородная сера -S Сульфиды Пирит –FeS2 Сульфаты Гипс-СаSO4*2H2O Мирабилит –Na2SO4*10H2O Горькая соль-MgSO4*7H2O
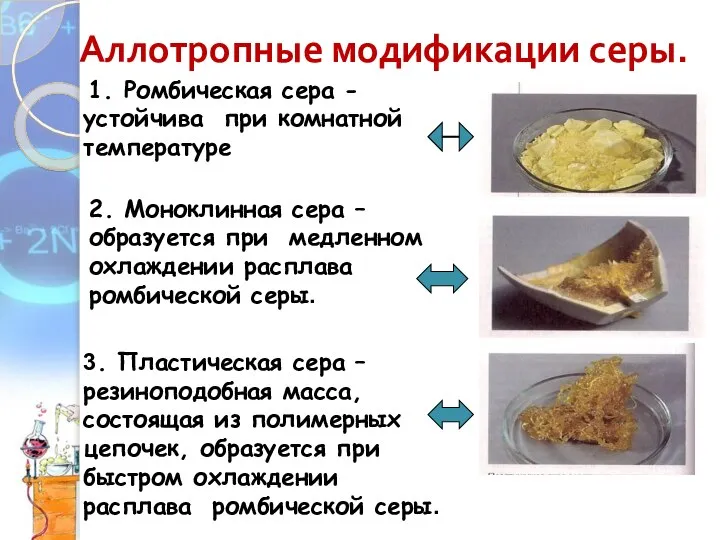
- 6. Аллотропные модификации серы. 1. Ромбическая сера - устойчива при комнатной температуре 2. Моноклинная сера – образуется
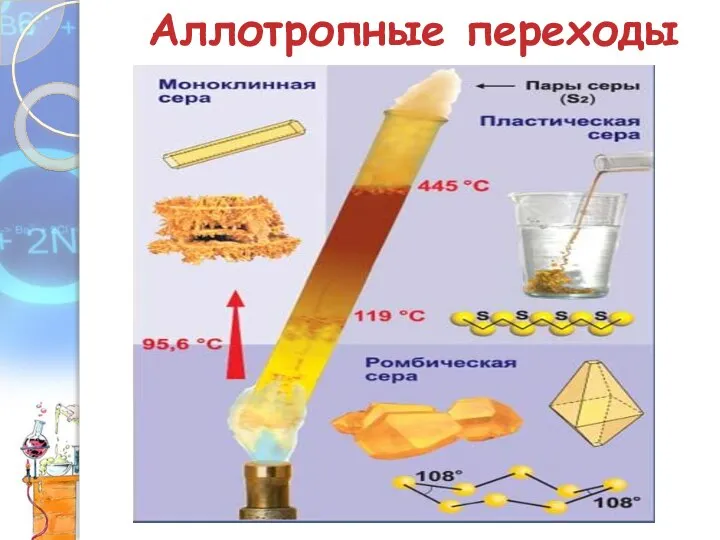
- 7. Аллотропные переходы
- 8. Физические свойства. — твердое вещество — желтого цвета — нерастворима в воде — не смачивается водой
- 9. Химические свойства серы S – окислитель S + 2е- = S-2 1.Взаимодействие с металлами Сu +
- 10. Химические свойства серы. S – восстановитель S – 2e- = S+2 S - 4e- = S+4
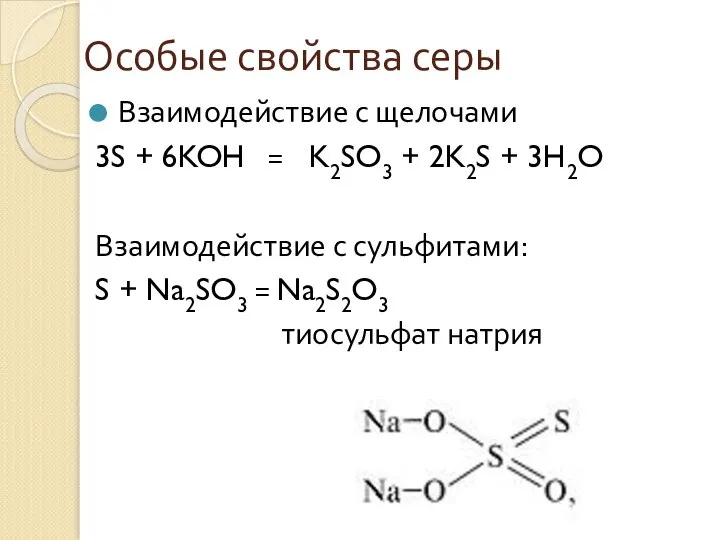
- 11. Особые свойства серы Взаимодействие с щелочами 3S + 6KOH = K2SO3 + 2K2S + 3H2O Взаимодействие
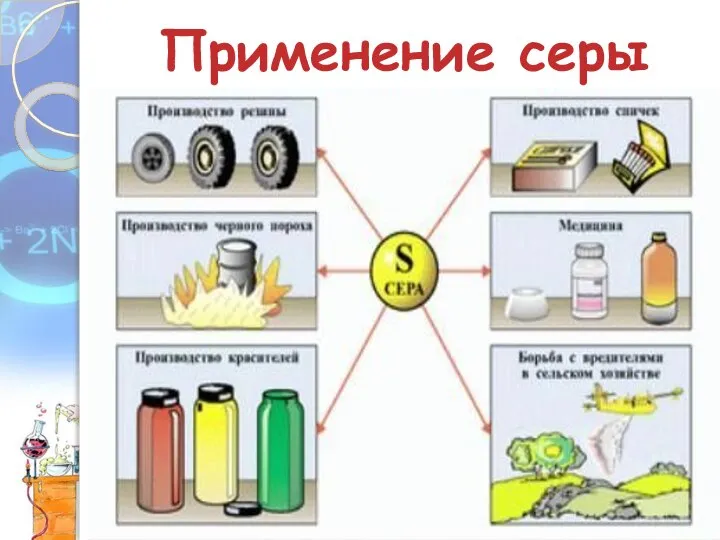
- 12. Применение серы
- 13. Содержится в вулканических газах и постоянно образуется на дне Черного моря. Образуется при гниение белков, поэтому
- 14. Получение FeS + 2HCl = FeCl2 + H2S
- 15. Свойства сероводорода Сероводород сильный восстановитель. Он легко сгорает в кислороде или на воздухе: 2Н2S + O2
- 16. А В С Легко окисляется галогенами, оксидом серы (VI), хлоридом железа (III): Н2S + Cl2 =
- 17. Сероводород хорошо растворим в спирте, хуже – воде (при комнатной температуре только 2,5 объема в одном
- 18. Как двухосновная кислота сероводородная кислота образует ряд солей – средние (сульфиды) и кислые (гидросульфиды): 2KOH +
- 19. Как и сероводород, сероводородная кислота и сульфиды являются сильными восстановителями: H2S + 2HNO3 (конц.) = S+
- 20. ZnS PbS
- 21. Оксид серы (IV) Получение: Происходит реакция обмена между сульфидом и раствором серной кислоты: Na2SO4 + H2SO4
- 22. Оксид серы (IV) - бесцветный газ с резким запахом, менее токсичен, чем сероводород, но лучше растворим
- 23. Оксид серы (IV): 1.Окислительные свойства SO2 + 2H2S = 3S + 2H2O 2. Восстановительные свойства :
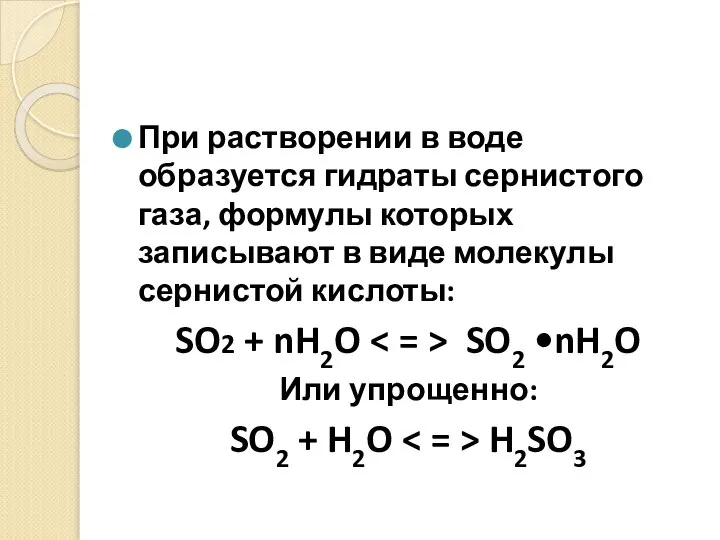
- 24. При растворении в воде образуется гидраты сернистого газа, формулы которых записывают в виде молекулы сернистой кислоты:
- 25. В водном растворе сернистого газа, часто называемого сернистой кислотой (такая кислота не существует в свободном виде),
- 26. Оксид серы (VI) : Оксид серы (VI)(серный ангидрид) получают как промежуточный продукт при производстве серной кислоты
- 29. Скачать презентацию




















 Сплавы Лекция 2
Сплавы Лекция 2 Железо Составил: учитель химии МОУ «Средняя общеобразовательная школа №92 с углубленным изучением отдельных предметов» Б
Железо Составил: учитель химии МОУ «Средняя общеобразовательная школа №92 с углубленным изучением отдельных предметов» Б Рождающий воду
Рождающий воду Презентация по Химии "Нафта" - скачать смотреть бесплатно
Презентация по Химии "Нафта" - скачать смотреть бесплатно Жири (тригліцериди)
Жири (тригліцериди) В гостях у Хозяйки Медной горы. Покровская сельская библиотека
В гостях у Хозяйки Медной горы. Покровская сельская библиотека Фазовые равновесия
Фазовые равновесия Предмет органической химии. Строение атома углерода
Предмет органической химии. Строение атома углерода Темір және оның маңызды қосылыстары
Темір және оның маңызды қосылыстары Биохимия белковых гормонов
Биохимия белковых гормонов Хімічні добавки. Е-числа Підготувала Учениця 11-А класу Макарівського НВК Заріцька Вікторія Вчитель:Гребенюк Олександра Іва
Хімічні добавки. Е-числа Підготувала Учениця 11-А класу Макарівського НВК Заріцька Вікторія Вчитель:Гребенюк Олександра Іва Химическая связь
Химическая связь Презентация по Химии "Глюкоза. Строение. Физические и химические свойства" - скачать смотреть
Презентация по Химии "Глюкоза. Строение. Физические и химические свойства" - скачать смотреть  Выдающиеся ученые - химики и их заслуги
Выдающиеся ученые - химики и их заслуги Неорганические вещества
Неорганические вещества Решение задачи №10. Гидроксид рубидия. Команда «Карбораны»
Решение задачи №10. Гидроксид рубидия. Команда «Карбораны» Количество вещества. Молярная масса. Задачи
Количество вещества. Молярная масса. Задачи Щелочноземельные металлы
Щелочноземельные металлы Задания на ЕГЭ
Задания на ЕГЭ Органическая химия
Органическая химия Щелочные и щелочноземельные металлы и их роль в организме человека
Щелочные и щелочноземельные металлы и их роль в организме человека Количественный анализ Химические методы анализа Гравиметрический анализ Титриметрический анализ Инструментальные методы
Количественный анализ Химические методы анализа Гравиметрический анализ Титриметрический анализ Инструментальные методы  Химические методы получения наночастиц
Химические методы получения наночастиц Кроссворд по теме: Алканы
Кроссворд по теме: Алканы Обчислення швидкості хімічних реакцій в залежності від концентрації реагуючих речовин і температури
Обчислення швидкості хімічних реакцій в залежності від концентрації реагуючих речовин і температури Молекулярные массы и гибкость полимеров
Молекулярные массы и гибкость полимеров Сполуки основних класів у будівництві і побуті
Сполуки основних класів у будівництві і побуті Состав раствора количественно характеризуется величинами концентраций
Состав раствора количественно характеризуется величинами концентраций