Содержание
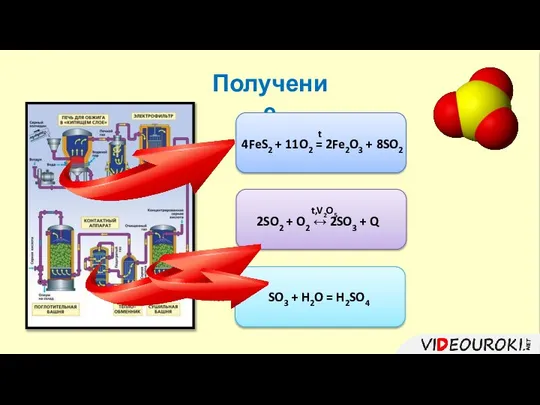
- 2. Получение S + O2 = SO2 2H2S + 3O2 = 2SO2 + 2H2O 4FeS2 + 11O2
- 3. Получение 2) Окисление оксида серы (IV) до оксида серы (VI). 2SO2 + O2 ↔ 2SO3 +
- 4. Эта летучая бесцветная жидкость; Имеет удушливый запах; При растворении в воде образует серную кислоту.
- 5. Получение 3) Растворение оксида серы (VI) в концентрированной серной кислоте. SO3 + H2O = H2SO4 Олеум
- 6. Получение SO3 + H2O = H2SO4
- 7. H2SO4 H2SO4 H2SO4
- 8. Серная кислота – бесцветная маслянистая и тяжёлая жидкость. Она обладает сильными гигроскопическими свойствами. Её используют для
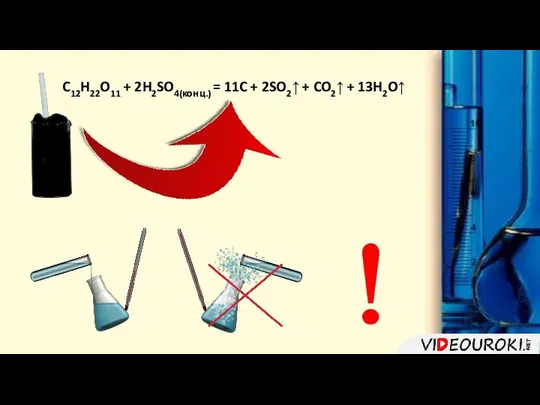
- 9. C12H22O11 + 2H2SO4(конц.) = 11C + 2SO2↑ + CO2↑ + 13H2O↑
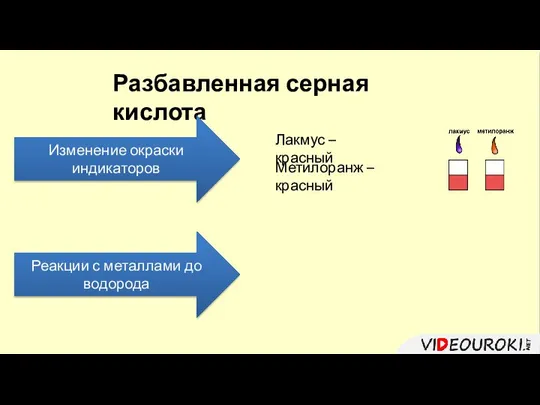
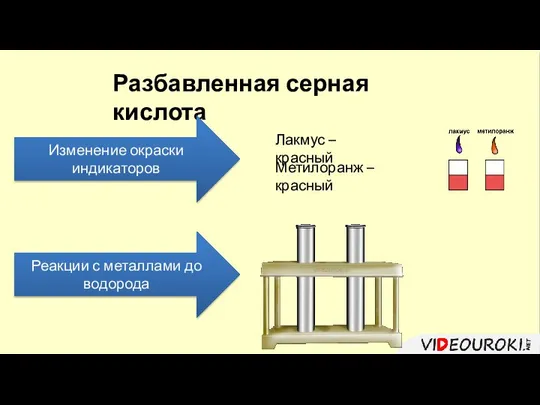
- 10. Разбавленная серная кислота Изменение окраски индикаторов Лакмус – красный Метилоранж – красный Реакции с металлами до
- 11. Разбавленная серная кислота Изменение окраски индикаторов Лакмус – красный Метилоранж – красный Реакции с металлами до
- 12. Разбавленная серная кислота Реакции с основными оксидами Zn + H2SO4 = ZnSO4 + H2↑ Cu +
- 13. Разбавленная серная кислота Реакции с основными оксидами Zn + H2SO4 = ZnSO4 + H2↑ 0 +2
- 14. Разбавленная серная кислота Реакции с основными оксидами Zn + H2SO4 = ZnSO4 + H2↑ 0 +2
- 15. Разбавленная серная кислота Реакции с основаниями
- 16. Разбавленная серная кислота Реакции с основаниями
- 17. Разбавленная серная кислота Реакции с основаниями 2NaOH + H2SO4 = Na2SO4 + 2H2O OH- + H+
- 18. Разбавленная серная кислота Реакции с основаниями 2NaOH + H2SO4 = Na2SO4 + 2H2O OH- + H+
- 19. Разбавленная серная кислота Реакции с основаниями 2NaOH + H2SO4 = Na2SO4 + 2H2O OH- + H+
- 20. Разбавленная серная кислота Реакции с основаниями CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4 Cu2+ + 2OH-
- 21. Разбавленная серная кислота Реакции с основаниями CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4 Cu2+ + 2OH-
- 22. Разбавленная серная кислота Реакции с солями
- 23. Разбавленная серная кислота Реакции с солями K2SO4 + CaCl2 = 2KCl + CaSO4↓ SO42- + Ca2+
- 24. Концентрированная серная кислота Реакции с металлами до Н2 4Zn + 5H2SO4(конц.) = 4ZnSO4 + H2S↑ +
- 25. Железо и алюминий пассивируются концентрированной серной кислотой.
- 26. Концентрированная серная кислота Реакции с солями Гидросульфат натрия NaCl (тв.) + H2SO4 (конц.) = NaHSO4 +
- 27. Серная кислота – это двухосновная кислота. Соли серной кислоты – сульфаты. Na2SO4 – сульфат натрия NaHSO4
- 29. Глауберова соль – Na2SO4 · 10H2O Гипс – CaSO4 · 2H2O Сульфат бария – BaSO4 Медный
- 30. Серную кислоту получают в три стадии. Серная кислота представляет собой тяжёлую маслянистую жидкость. При разбавлении концентрированной
- 32. Скачать презентацию

























 Презентация по химии Реакции окисления и восстановления органических соединений
Презентация по химии Реакции окисления и восстановления органических соединений  Н2, NaCl, Ca, HCl
Н2, NaCl, Ca, HCl Роль химии в сохранении окружающей среды
Роль химии в сохранении окружающей среды Лекция 8. Нуклеофильное присоединение к кратным связям углерод-гетероатом. Карбонильные соединения
Лекция 8. Нуклеофильное присоединение к кратным связям углерод-гетероатом. Карбонильные соединения Интернет-тренажеры
Интернет-тренажеры Масс-Спектроскопия
Масс-Спектроскопия Обмен липидов-2
Обмен липидов-2 Изотопы Учитель Страшнова Татьяна Анатольевна
Изотопы Учитель Страшнова Татьяна Анатольевна Что у алхимика в пробирке?
Что у алхимика в пробирке? Основы коррозии и защиты металлов
Основы коррозии и защиты металлов Этот удивительный Мир симметрии - презентация_
Этот удивительный Мир симметрии - презентация_ Галогены. Физические свойства
Галогены. Физические свойства Оксид цинка
Оксид цинка Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды Современные положения теории А.М. Бутлерова
Современные положения теории А.М. Бутлерова Применимость геохимических правил к распространенности лантанидов в земной коре
Применимость геохимических правил к распространенности лантанидов в земной коре Классификация моторных масел по стандартам API
Классификация моторных масел по стандартам API Екологічні проблеми при переробці вуглеводнів Бондаренко Н. 11-А
Екологічні проблеми при переробці вуглеводнів Бондаренко Н. 11-А  Аскорбиновая кислота. Глютаминовая кислота. Кислота аминокапроновая
Аскорбиновая кислота. Глютаминовая кислота. Кислота аминокапроновая Презентация «Силикатная промышленность» МОУ «Средняя общеобразовательная
Презентация «Силикатная промышленность» МОУ «Средняя общеобразовательная  Нефть. Способы её переработки. Продукты переработки нефти
Нефть. Способы её переработки. Продукты переработки нефти Презентация по Химии "Получение сложнооксидных нано- и микроматериалов методом пиролиза полимерно-солевых композиций" - скач
Презентация по Химии "Получение сложнооксидных нано- и микроматериалов методом пиролиза полимерно-солевых композиций" - скач Химический диктант. Свойства галогенов
Химический диктант. Свойства галогенов Этил спирті және оның адам ағзасына әсері
Этил спирті және оның адам ағзасына әсері Колообіг нітрогену Колообіг речовин — основна властивість, характерна риса біосфери.
Колообіг нітрогену Колообіг речовин — основна властивість, характерна риса біосфери.  Волокна. Классификация волокон
Волокна. Классификация волокон 20151216_udivitelnyy_mir_kamney_chast_1_0
20151216_udivitelnyy_mir_kamney_chast_1_0 Угольная кислота и ее производные. Сульфокислоты. (Лекция 12)
Угольная кислота и ее производные. Сульфокислоты. (Лекция 12)