Содержание
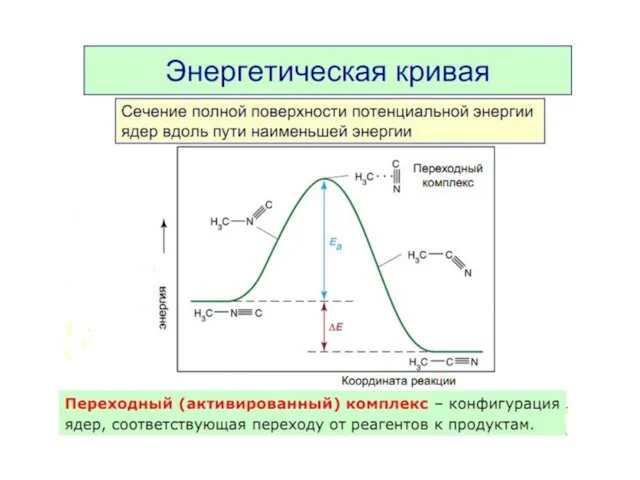
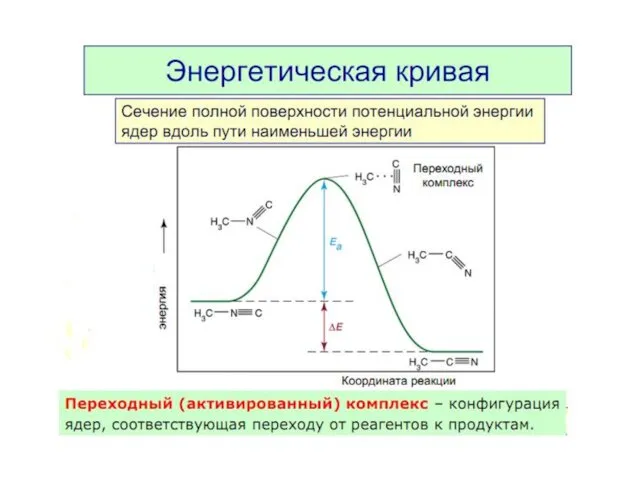
- 8. Энергия активации Еа — это энергия, которую надо сообщить 1 моль вещества, чтобы его молекулы стали
- 15. H2 + I2 = 2HI 1) I2 hν I· + ·I 2) ·I + H–H I
- 24. Формальным порядком реакции называется показатель степени в кинетическом уравнении реакции, определяемый экспериментально. Порядок реакции — это
- 25. Два способа экспериментального определения порядка реакции: 1) составляются кинетические уравнения для реакций 1-го, 2-го и 3-го
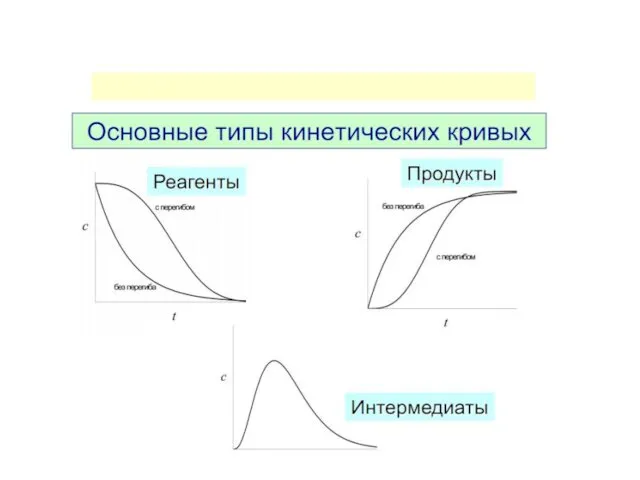
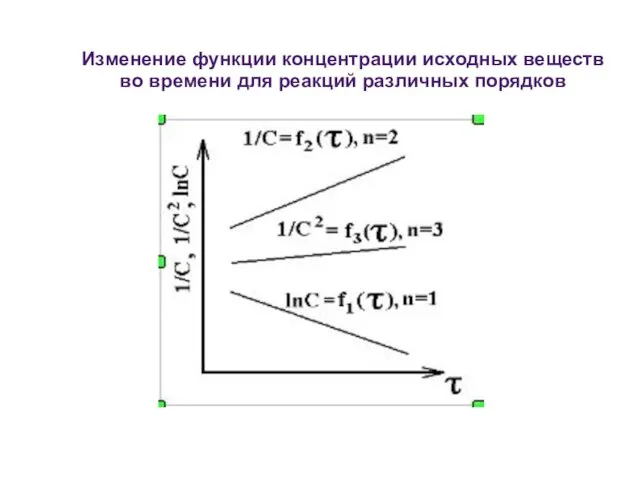
- 26. Изменение функции концентрации исходных веществ во времени для реакций различных порядков
- 27. 2) Используя логарифмическую форму кинетического уравнения r = k·cn , lgr = lgk + n·lgc из
- 28. Молекулярность реакции — число молекул, принимающих участие в элементарном акте химического превращения. Существуют одно-, двух- и
- 29. Зависимость скорости реакции от температуры и природы реагирующих веществ описывает уравнение Аррениуса: k — константа скорости
- 30. Каким образом можно ускорить реакцию? - увеличить температуру - снизить энергию активации Катализаторы — вещества, участвующие
- 31. Энергетическая диаграмма реакции без катализатора и с катализатором.
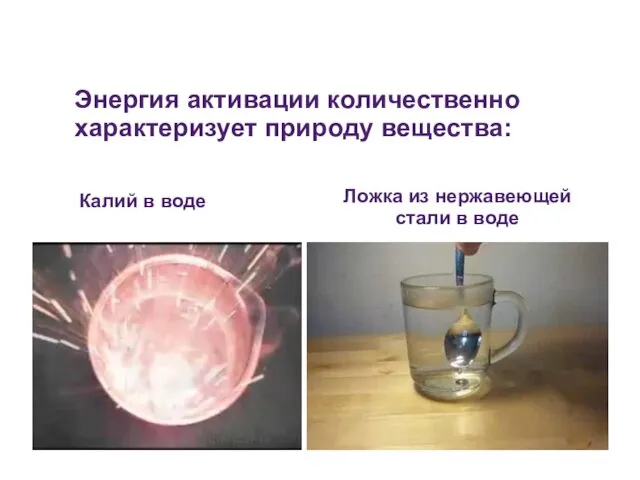
- 32. Энергия активации количественно характеризует природу вещества: Калий в воде Ложка из нержавеющей стали в воде
- 33. Определение энергии активации по константам реакции, определенным при двух температурах:
- 34. Если Еа лежит в диапазоне 50-100 кДж/моль, то влияние температуры на скорость можно оценить по эмпирическому
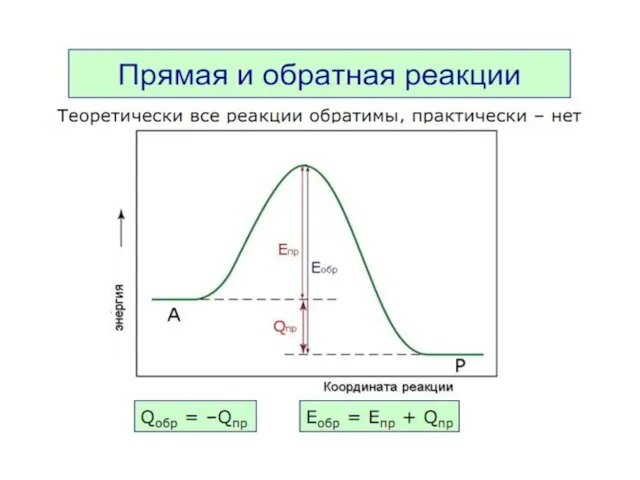
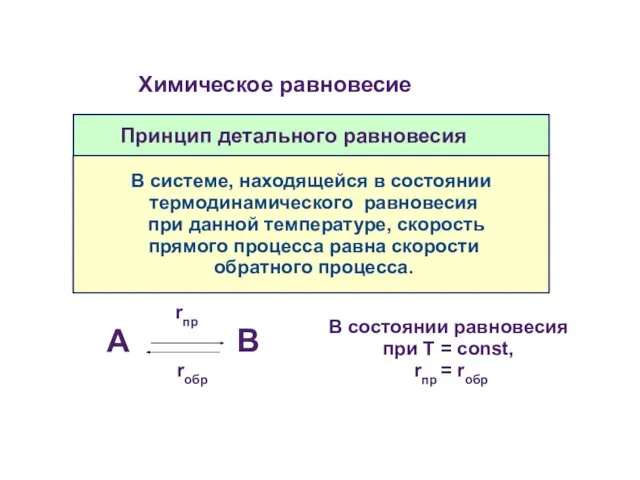
- 35. Принцип детального равновесия В системе, находящейся в состоянии термодинамического равновесия при данной температуре, скорость прямого процесса
- 36. Если на систему, находящуюся в равновесии, оказывается внешнее воздействие (Т, р, С), равновесие системы смещается в
- 37. Задача: В реакции синтеза аммиака исходные концентрации азота и водорода составляли соответственно 5 и 10 моль/л.
- 39. Скачать презентацию
























 Йод
Йод Редукторные масла Лукойл
Редукторные масла Лукойл Проект познавательно-исследовательской деятельности. Удивительная соль
Проект познавательно-исследовательской деятельности. Удивительная соль Электрохимические цепи
Электрохимические цепи Презентация по Химии "Синтетические моющие средства." - скачать смотреть бесплатно_
Презентация по Химии "Синтетические моющие средства." - скачать смотреть бесплатно_ Лекарственные растения, содержащие простые фенолы, лигнаны и кумарины
Лекарственные растения, содержащие простые фенолы, лигнаны и кумарины Властивості етанової (оцтової) кислоти
Властивості етанової (оцтової) кислоти ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ 1.ОВР.Классификация ОВР. 2.Метод электронного баланса. 3.Метод полуреакций.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ 1.ОВР.Классификация ОВР. 2.Метод электронного баланса. 3.Метод полуреакций.  Миорелаксанты. Общая характеристика
Миорелаксанты. Общая характеристика Характеристика рынка. Тенденции мирового рынка сверхчистого оксида алюминия
Характеристика рынка. Тенденции мирового рынка сверхчистого оксида алюминия Качественные реакции. Катионы
Качественные реакции. Катионы Инсектициды на основе бакуловирусов
Инсектициды на основе бакуловирусов Основные требования к химическим реакторам
Основные требования к химическим реакторам Строение вещества. Диффузия. Броуновское движение
Строение вещества. Диффузия. Броуновское движение Презентация по Химии "НИТРАТЫ. ИХ ВЛИЯНИЕ НА ЗДОРОВЬЕ ЛЮДЕЙ" - скачать смотреть бесплатно
Презентация по Химии "НИТРАТЫ. ИХ ВЛИЯНИЕ НА ЗДОРОВЬЕ ЛЮДЕЙ" - скачать смотреть бесплатно Типы окисления. Понятие об антиоксидантной системе
Типы окисления. Понятие об антиоксидантной системе  Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений Третий закон Менделя. Урок 4
Третий закон Менделя. Урок 4 Металлы. Положение в ПСХЭ Д.И. Менделеева. Физические свойства металлов .
Металлы. Положение в ПСХЭ Д.И. Менделеева. Физические свойства металлов . Презентация по химии Кислоты 8 класс
Презентация по химии Кислоты 8 класс Свойства и применение уксусной кислоты
Свойства и применение уксусной кислоты Химические свойства металлов
Химические свойства металлов Коррозия металлов
Коррозия металлов Трансмиссионные масла
Трансмиссионные масла Берилій
Берилій Ионные равновесия в растворах электролитов
Ионные равновесия в растворах электролитов Аттестационная работа. Использование цифровой лаборатории «Архимед» во внеурочной деятельности по химии
Аттестационная работа. Использование цифровой лаборатории «Архимед» во внеурочной деятельности по химии Молекулярное строение твердых тел, жидкостей и газов
Молекулярное строение твердых тел, жидкостей и газов