Содержание
- 2. Цели урока: 1)Познакомить учащихся с понятием соли, изучить основные классификации солей; 2)Изучить основные химические свойства солей;
- 3. Что такое соли? Соли–это сложные вещества, образованные атомами металлов и кислотными остатками
- 4. Номенклатура солей Название Название Указание Кислотного + металла (в Р.п.) + валентности остатка (если она переменная)
- 5. Классификация солей По растворимости в воде Растворимые Нерастворимые Малорастворимые Аммиачная селитра NH4NO3 Сульфат кальция Фосфат железа
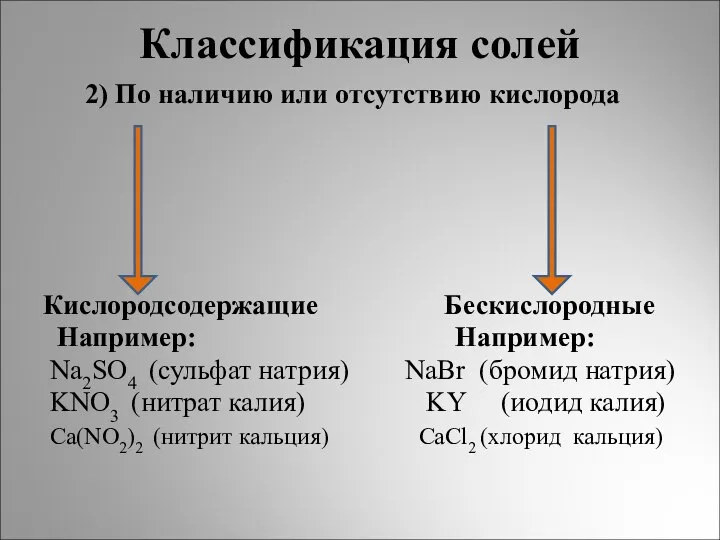
- 6. Классификация солей 2) По наличию или отсутствию кислорода Кислородсодержащие Бескислородные Например: Например: Na2SO4 (сульфат натрия) NaBr
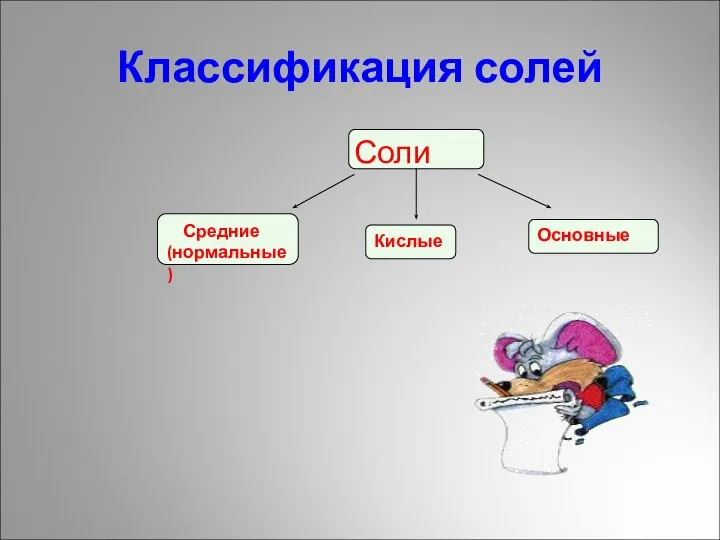
- 7. Классификация солей Соли Средние (нормальные) Кислые Основные
- 8. Разновидности солей Соли бывают: Средние соли – это продукты полного замещения атомов водорода в кислоте на
- 9. Разновидности солей 2) Кислые соли – это продукты неполного замещения атомов водорода в кислоте на металл.
- 10. Разновидности солей 3) Основные соли – это продукты неполного замещения гидроксогрупп в основании на кислотный остаток.
- 11. Физические свойства: Все соли твердые кристаллические вещества. Соли имеют различную окраску, и разную растворимость в воде.
- 12. Химические свойства Соль + кислота = другая соль + другая кислота Например: H2SO4 + BaCl2 =
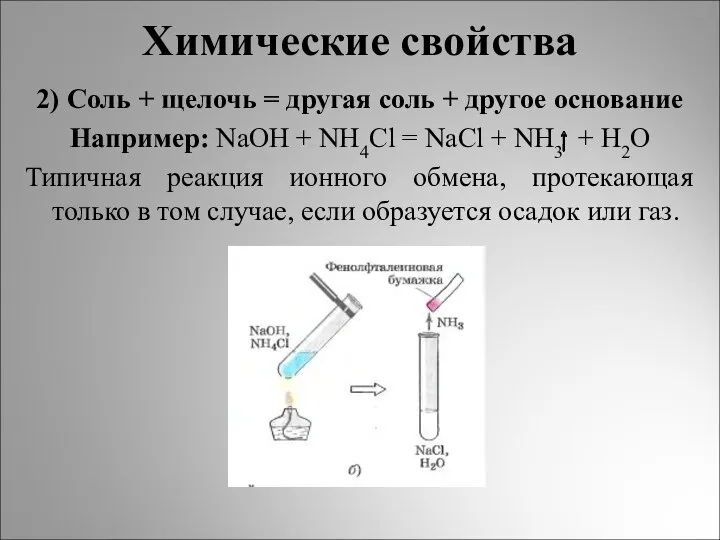
- 13. Химические свойства 2) Соль + щелочь = другая соль + другое основание Например: NaOH + NH4Cl
- 14. Химические свойства 3) Соль1 + соль2 = соль3 + соль4 Например: Na2SO4 + BaCl2 = BaSO4
- 15. Химические свойства 4) Соль + металл = другая соль + другой металл Например: CuSO4(p-p) + Fe
- 16. Получение солей: 1. Взаимодействие кислоты с Ме: Zn + 2HCI → ZnCI2 + H2 2. Взаимодействие
- 17. Применение солей - в стирке, с помощью порошка, с состав которого входит стиральная (кальцинированная) сода –
- 18. Мрамор, известняк, мел
- 20. Скачать презентацию














 Осадочные горные породы
Осадочные горные породы Презентация по Химии "Кристаллы вокруг нас" - скачать смотреть
Презентация по Химии "Кристаллы вокруг нас" - скачать смотреть  Серная кислота
Серная кислота Классификация моторных масел по стандартам API
Классификация моторных масел по стандартам API Характерные дефекты в монокристаллах кремния и их влияние на свойства. Методы диагностики
Характерные дефекты в монокристаллах кремния и их влияние на свойства. Методы диагностики Амины. Общая характеристика, номенклатура, изомерия. Получение. Физико-химические свойства. Отдельные представители
Амины. Общая характеристика, номенклатура, изомерия. Получение. Физико-химические свойства. Отдельные представители Синтетические моющие средства.(СМС) Подготовила Живулько Елена.
Синтетические моющие средства.(СМС) Подготовила Живулько Елена. Бромды метил буының концентрациясын анықтау тәсілдемесі
Бромды метил буының концентрациясын анықтау тәсілдемесі The way to prepare gold clusters - Every atom makes a difference
The way to prepare gold clusters - Every atom makes a difference Алканы. Циклоалканы
Алканы. Циклоалканы Скорость химической реакции. Порядок и молекулярность реакции. Катализ
Скорость химической реакции. Порядок и молекулярность реакции. Катализ Чаи: знакомые и не знакомые
Чаи: знакомые и не знакомые Атомы, молекулы и ионы
Атомы, молекулы и ионы Важнейшие минералы
Важнейшие минералы Моделирование химико-технологических процессов. Лекция № 1-2
Моделирование химико-технологических процессов. Лекция № 1-2 Реакция поликонденсации фенолов с формальдегидами
Реакция поликонденсации фенолов с формальдегидами Аппараты основных химических производств
Аппараты основных химических производств Моторные масла. Свойства, состав, классификация
Моторные масла. Свойства, состав, классификация Секвенирование Ion Chip. Технология CMOS и устройство чипа для секвенирования
Секвенирование Ion Chip. Технология CMOS и устройство чипа для секвенирования Несколько слов о химии
Несколько слов о химии Арилалкиламины, гидроксифенилалкиламины и их производные
Арилалкиламины, гидроксифенилалкиламины и их производные Применение спиртов и простых эфиров
Применение спиртов и простых эфиров Огнеупорные материалы
Огнеупорные материалы Природний газ
Природний газ Процесс травления тонких линий
Процесс травления тонких линий Основные понятия и законы химии
Основные понятия и законы химии Дисперсные системы. Основные понятия
Дисперсные системы. Основные понятия Химия неметаллов
Химия неметаллов