Содержание
- 2. Строение электронных оболочек атомов Задачи урока: Познакомиться со строением электронных оболочек атомов Научиться составлять схемы строения
- 3. Соотнесите химические формулы и формы существования химических элементов 1) 2S 2) S8 3) 3H2O 4) Al2O3
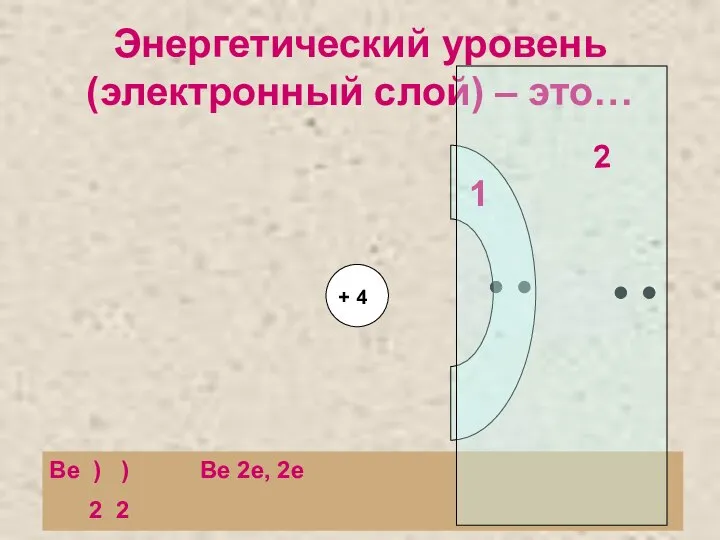
- 4. Энергетический уровень (электронный слой) – это… Be ) ) Be 2e, 2e 2 2 + 4
- 5. Число энергетических уровней = номеру периода Максимальное число электронов на уровне = 2 n2 1 уровень
- 6. Запишите схемы строения электронных оболочек атомов: углерода, азота,кислорода, фтора. Соотнесите число электронов на внешнем уровне и
- 7. Повторение 1. Электроны в атомах располагаются … 2. Электроны одного энергетического уровня имеют примерно одинаковый …
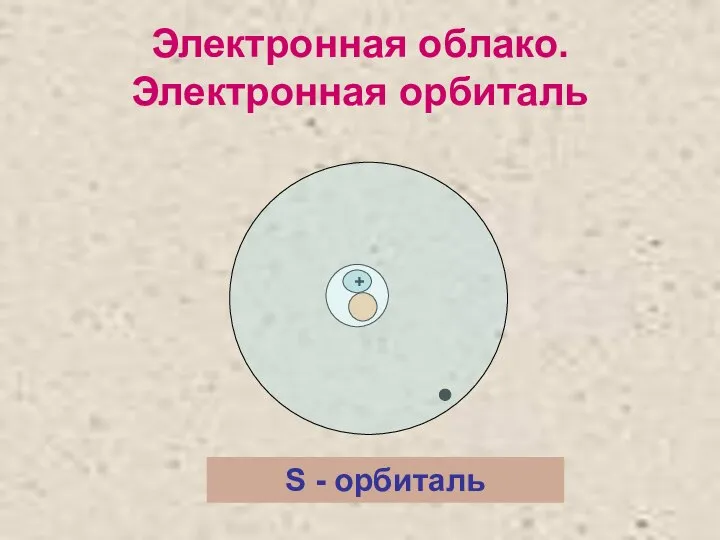
- 8. Электронная облако. Электронная орбиталь + S - орбиталь
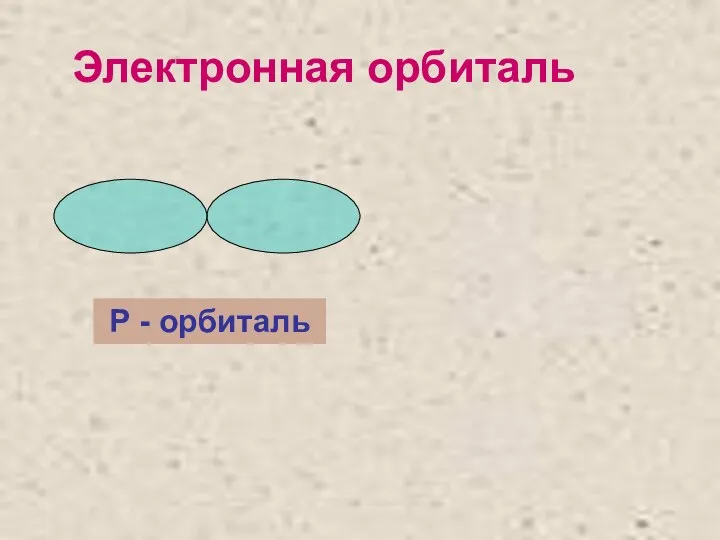
- 9. Электронная орбиталь Р - орбиталь
- 10. Электронная орбиталь Р - орбитали
- 11. На одной орбитали не может находится более 2 электронов Количество орбиталей на уровнях равно номеру уровня.
- 12. Электронные формулы H )1 1S1 He )2 1S2 C )2 )4 1S2 2S22P2 O F Na
- 13. Повторение 1. Пространство вокруг ядра атома ,где наиболее вероятно нахождение электрона называют …. 2. S и
- 15. Скачать презентацию









 Топлива и их свойства. Топлива автомобилей
Топлива и их свойства. Топлива автомобилей Вода - растворитель
Вода - растворитель Щелочные металлы
Щелочные металлы Амфотерні гідроксиди
Амфотерні гідроксиди Личностно – ориентированный подход в обучении химии Талавир С.Е. Учитель химии МОУ СОШ№5
Личностно – ориентированный подход в обучении химии Талавир С.Е. Учитель химии МОУ СОШ№5 Химические реакции. Скорость реакции
Химические реакции. Скорость реакции Понятие о коррозии металлов. Способы защиты от коррозии
Понятие о коррозии металлов. Способы защиты от коррозии Соли в природе. Реакции с участием солей. Модуль 2. Лекция 2.1
Соли в природе. Реакции с участием солей. Модуль 2. Лекция 2.1 Centrifugal Ultrafiltration Devices
Centrifugal Ultrafiltration Devices Ацетилен
Ацетилен Производные углеводородов с одновалентной функцией
Производные углеводородов с одновалентной функцией Свойства моторных топлив
Свойства моторных топлив Безопасная помада
Безопасная помада Вода - чудо, сотворенное природой
Вода - чудо, сотворенное природой Именные реакции в органической химии
Именные реакции в органической химии Физические явления - основа разделения смесей в химии
Физические явления - основа разделения смесей в химии Алкилирование изобутана олефинами
Алкилирование изобутана олефинами Алкины. Свойства, получение и применение
Алкины. Свойства, получение и применение Основные этапы развития химии комплексных соединений Лектор: канд. хим. наук, ст. преп. Камиль Абрарович Сагдеев
Основные этапы развития химии комплексных соединений Лектор: канд. хим. наук, ст. преп. Камиль Абрарович Сагдеев Аренкарбонільні комплекси металів у реакціях перфлюороалкілювання та деароматизації
Аренкарбонільні комплекси металів у реакціях перфлюороалкілювання та деароматизації Роль хімії у житті суспільства.
Роль хімії у житті суспільства.  Хімічні методи підвищення продуктивності свердловини
Хімічні методи підвищення продуктивності свердловини Выделение урана из растворов (пульп)
Выделение урана из растворов (пульп) Ионное произведение воды. Понятие о рН раствора
Ионное произведение воды. Понятие о рН раствора Теоретическое и прикладное материаловедение
Теоретическое и прикладное материаловедение Атомы и молекулы. Простые и сложные вещества. 8 класс
Атомы и молекулы. Простые и сложные вещества. 8 класс Нанокомпозиционный материал на основе фенолоформальдегидной смолы, эпоксидной смолы, полистирола
Нанокомпозиционный материал на основе фенолоформальдегидной смолы, эпоксидной смолы, полистирола Важнейшие классы неорганических соединений Школа № 279 г. Санкт-Петербург Е. В Переверзева
Важнейшие классы неорганических соединений Школа № 279 г. Санкт-Петербург Е. В Переверзева