Содержание
- 2. ВСПОМНИМ Чему равно общее количество электронов в атоме? Что такое энергетический уровень? Как определить число энергетических
- 3. ЗАПОМНИМ Электроны, расположенные на последней электронной оболочке, называются внешними. Число внешних электронов для химических элементов главных
- 4. Проверим домашнее задание
- 5. Проверьте себя и поставьте оценку, равную количеству правильных ответов Задание 1 Вариант I - а) Al
- 6. ТЕМА УРОКА «Строение электронных оболочек атомов химических элементов №1-20»
- 7. Цель урока: научиться составлять электронные формулы атомов элементов первых трех периодов ПСХЭ; объяснять зависимость и закономерные
- 8. Электронная оболочка Совокупность всех электронов в атоме, окружающих ядро Каждый электрон имеет свою траекторию движения и
- 9. S – облако p- облака d - облака Область наиболее вероятного местонахождения электрона в пространстве Форма
- 10. Алгоритм составления электронных формул. Записываем знак химического элемента и заряд ядра его атома – он равен
- 11. 1 период Н + 1 1 n=1 S 1 S1 Нe + 2 2 n=1 S
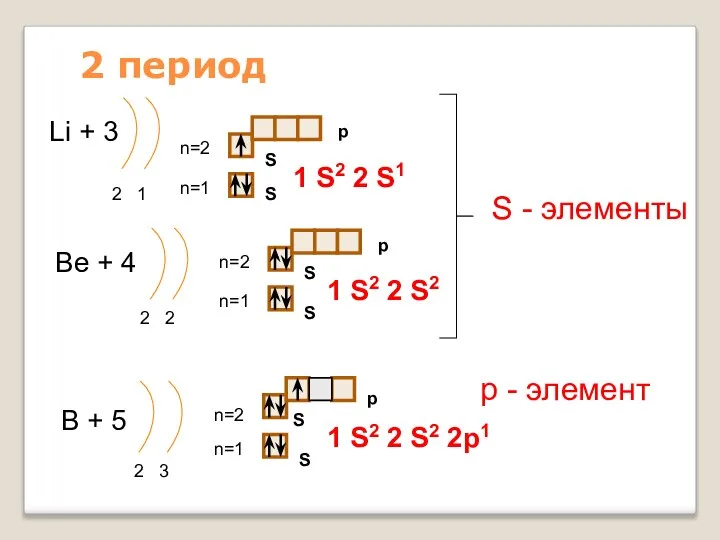
- 12. 2 период Li + 3 2 1 n=1 n=2 1 S2 2 S1 Be + 4
- 13. 2 период С + 6 2 4 n=1 n=2 N + 7 2 5 n=1 n=2
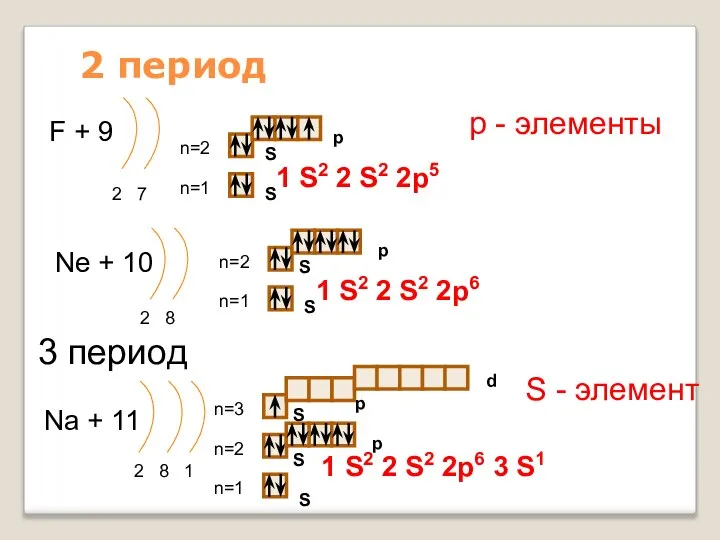
- 14. 2 период F + 9 2 7 n=1 n=2 Ne + 10 2 8 n=1 n=2
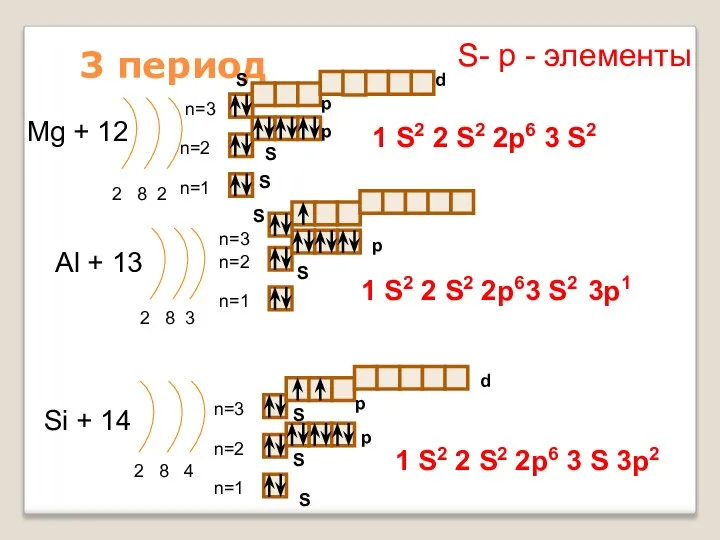
- 15. 3 период Mg + 12 2 8 2 n=1 n=2 Al + 13 2 8 3
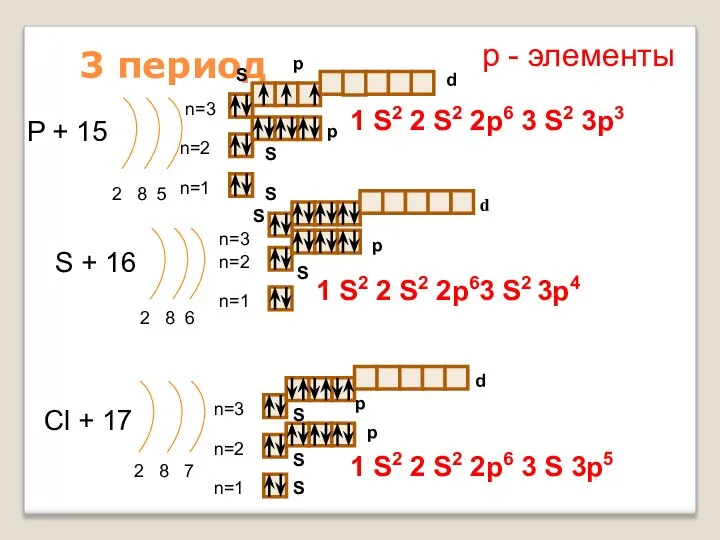
- 16. 3 период P + 15 2 8 5 n=1 n=2 S + 16 2 8 6
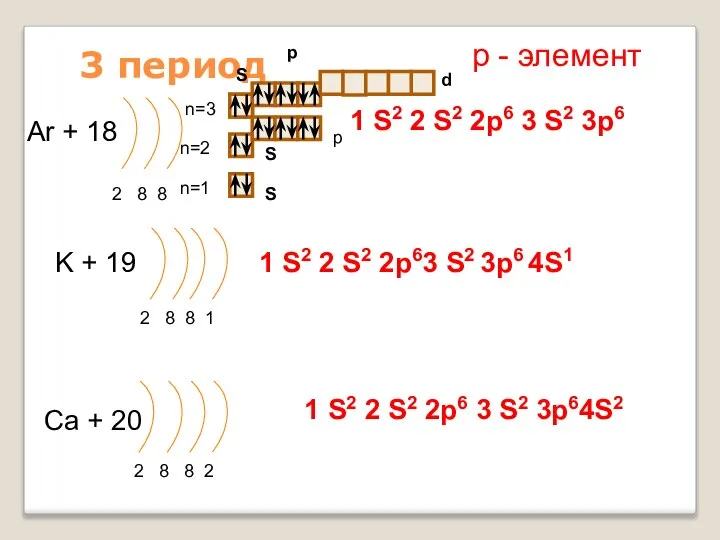
- 17. 3 период Ar + 18 2 8 8 n=1 n=2 K + 19 2 8 8
- 18. Физкультминутка Следим глазами
- 19. Закрепление материала Определить число орбиталей http://files.school-collection.edu.ru/dlrstore/bb14a031-aae7-11db-abbd-0800200c9a66/ch08_08_04.swf Определить число электронов на внешнем электронном уровне http://files.school-collection.edu.ru/dlrstore/bb14a032-aae7-11db-abbd-0800200c9a66/ch08_08_05.swf Определить общее
- 20. Ответьте на вопросы Какие данные об особенностях строения атома отражает электронная формула? В чем заключается причина
- 21. Выводы Причина сходства элементов заключается в одинаковом строении внешних энергетических уровней их атомов Одинаковое строение внешних
- 22. Домашнее задание Повторить основные понятия темы на странице с.46-53 учебника Задание №2, 3 письменно
- 24. Скачать презентацию
















 Алюміній оксид Al2O3
Алюміній оксид Al2O3  Гетероциклические соединения
Гетероциклические соединения Красители: натуральные или искусственные?
Красители: натуральные или искусственные? Строение и функция белков
Строение и функция белков Эндоскопические методы гемостаза
Эндоскопические методы гемостаза Азолы. Гетероциклы с двумя гетероатомами
Азолы. Гетероциклы с двумя гетероатомами Предельные углеводороды ( по химии для учащихся 9 класса)
Предельные углеводороды ( по химии для учащихся 9 класса) Электрохимические методы анализа. Лекция 3
Электрохимические методы анализа. Лекция 3 Химия в разных науках
Химия в разных науках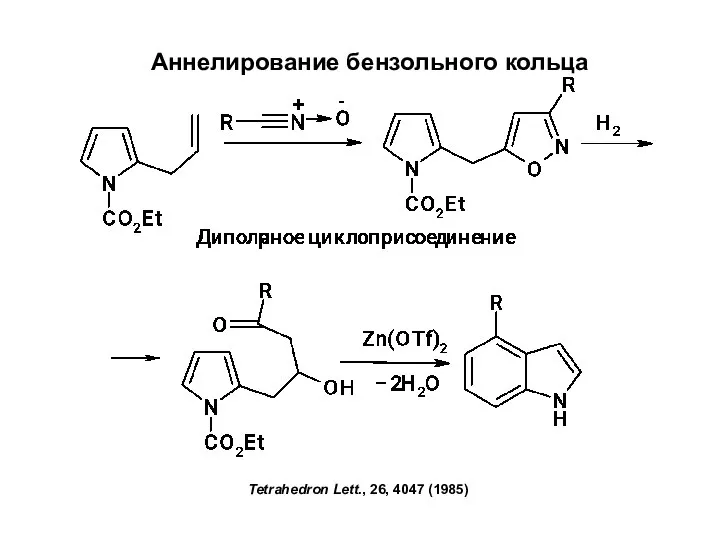 Аннелирование бензольного кольца
Аннелирование бензольного кольца Строение металлов
Строение металлов Нафта, склад, особливості залягання Підготувала учениця 2 курсу природничого класу Ніжинського ліцею ніжинської міської ради
Нафта, склад, особливості залягання Підготувала учениця 2 курсу природничого класу Ніжинського ліцею ніжинської міської ради  Жаңа дәрілерді жасау
Жаңа дәрілерді жасау Видатні вітчизняні хіміки
Видатні вітчизняні хіміки Термохимия. Типы энтальпии
Термохимия. Типы энтальпии Презентация по химии ПЕПТИДЫ и Белки
Презентация по химии ПЕПТИДЫ и Белки  ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА ПО ХИМИИ
ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА ПО ХИМИИ Методы исследования гидрохимического режима водоемов
Методы исследования гидрохимического режима водоемов Презентация по Химии "азотная кислота" - скачать смотреть бесплатно
Презентация по Химии "азотная кислота" - скачать смотреть бесплатно Программа повышения квалификации. Каталитические процессы в глубокой переработке нефти
Программа повышения квалификации. Каталитические процессы в глубокой переработке нефти Презентация по Химии "Презентация Золото" - скачать смотреть
Презентация по Химии "Презентация Золото" - скачать смотреть  Химия, 8 класс УЧИТЕЛЬ Краснова Оксана Владимировна
Химия, 8 класс УЧИТЕЛЬ Краснова Оксана Владимировна  Расчет концентрационных пределов воспламенения жидкости
Расчет концентрационных пределов воспламенения жидкости Решение экспериментальных задач по теме металлы
Решение экспериментальных задач по теме металлы Посуда, ее виды и использование. Работу выполнила Гливинская Анастасия ученица 9 класса МБОУ «СОШ №11»
Посуда, ее виды и использование. Работу выполнила Гливинская Анастасия ученица 9 класса МБОУ «СОШ №11»  Стадии и общая схема почвообразования
Стадии и общая схема почвообразования Аттестационная работа. Окраска ткани природными красителями
Аттестационная работа. Окраска ткани природными красителями Химия в содружестве с другими науками
Химия в содружестве с другими науками