Содержание
- 2. Мазмұны: Периодтық жүйедегі орны және атом құрылысы Табиғатта таралуы Өнеркәсіпте алынуы Физикалық қасиеттері Химиялық қасиеттері Темірдің
- 3. Жалпы сипаттама. Периодтық жүйедегі орны және атом құрылысы Темір – VIIIБ топ элементі, d - элемент.
- 4. Электрондық формуласы: 1s2 2s2 2p6 3s2 3p6 3d6 4s2 1s2 2s2 2p6 3s2 3p6 3d6 4s2
- 5. Темір химиялық реакцияларда 2 немесе 3 электрон беріп, өзінің тұрақты қосылыстарында +2 және +3 тотығу дәрежелерін
- 6. Табиғатта таралуы Темір – табиғатта таралуы бойынша екінші металл. Оның жер қыртысындағы үлесі 5,1%. Көптеген метеориттердің
- 7. Next
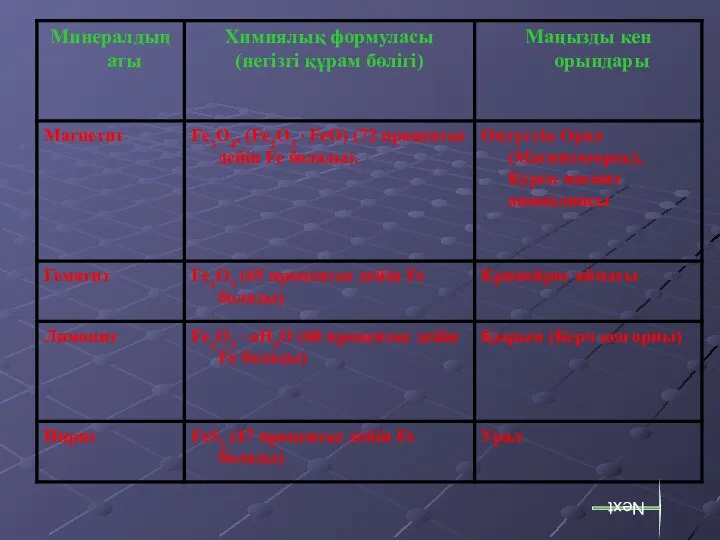
- 8. Минералдар: Магнетит Гематит Next
- 9. Лимонит Пирит
- 10. Қазақстанда темірдің бай қоры бар, ол Торғай темір кенді бассейнінде және Орталық Қазақстанда орналасқан. Қазіргі кезде
- 11. Өнеркәсіпте алынуы: Темірді 3 түрлі әдіспен алуға болады: Пирометаллургиялық әдіспен: оксидінен тотықсыздандыру арқылы: Fe2O3 + 3H2
- 12. Физикалық қасиеттері: Темір – жылтыр, күміс түстес ақ металл, оның тығыздығы – 7,87 г/см3. Балқу температурасы
- 13. Химиялық қасиеттері: I. Жай заттармен әрекеттесуі: Темір оттекте жанғанда екі тотығу дәрежесін де (+2, +3) көрсетеді,
- 14. Ылғалды ауада тат түзеді: 4Fe + 2H2O + 3O2 = 4FeO(OH) Белсенді бейметалдар темірді тотықтырады: 2Fe
- 15. II. Күрделі заттармен әрекеттесуі: Қатты қыздырылған темір су буымен әрекеттеседі: Fe + H2O = FeO +
- 16. Темірдің маңызды қосылыстары: Темір (ІІ) оксиді немесе (FeO) – негіздік оксид, оңай тотығатын қара ұнтақ, оны
- 17. Темір (ІІІ) оксиді Fe2O3 – амфотерлі оксид, бірақ негіздік қасиеті басымдау, ең тұрақты оксид, қызыл-қоңыр түсті,
- 18. Темірдің гидроксидтері Темірдің ІІ және ІІІ валентті оксидтеріне екі түрлі гидроксидтері сәйкес келеді. Fe (II) гидроксиді
- 19. Темірдің маңызды қосылыстарын анықтау: Fe+2 және Fe+3 иондарын сары және қызыл қан тұздарының көмегімен анықтайды. 3FeCl2
- 20. Қолданылуы: Темір купоросы (FeSO4 ∙ 7H2O) – ағаш сүрлеуде; Fe3C – цементит шойында қолданылады. (NH4)2SO4 ∙
- 21. Ат әбзелдері. Құрамы: темір, күміс және т.б. Ұзындығы 24 см. ХІ ғ-да жасалған. Next
- 22. Ерте кездегі темірден жасалған қайшы. Ұзындығы – 15,5 см. XIV ғасырдың екінші жартысы. Next
- 23. Next
- 24. Балта. Ұзындығы – 16 см. ХІ ғасыр. Next
- 25. Темірден жасалған құлып. Ұзындығы – 8,5 см. ХІІ ғасыр. Next
- 26. Next
- 27. Темірден жасалған әр түрлі қару-жарақтар. Х – ХІІ ғасырлар. Next
- 28. Темірден жасалған кілттер Back
- 29. Құрамында темір бар қосылыстар. Кальций силикаты және темір Хром және темір қосылыстары Темір, ванадий және т.б.
- 30. Back
- 31. Next
- 32. Next
- 33. Back
- 34. Back
- 35. Back
- 36. Back
- 37. Back
- 38. Темірдің құймалары: Next
- 40. Скачать презентацию




































 Реакция нейтрализации
Реакция нейтрализации Структура материалов
Структура материалов Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования
Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования Природные источники углеводородов
Природные источники углеводородов Перспективы использования оксигенатов в моторных топливах
Перспективы использования оксигенатов в моторных топливах Физические и химические свойства меди
Физические и химические свойства меди Корень как часть слова
Корень как часть слова  Новые пути использования парафиновых углеводородов
Новые пути использования парафиновых углеводородов Современные проблемы геологии. Изотопный взгляд на проблему
Современные проблемы геологии. Изотопный взгляд на проблему Металлы. Распространённость металлов в земной коре
Металлы. Распространённость металлов в земной коре ХАРЧОВІ ДОБАВКИ ПІДГОТУВАЛА СОКОЛОВСЬКА АЛЬОНА УЧЕНИЦЯ 8А КЛАСУ КНЗ ХЕЛ
ХАРЧОВІ ДОБАВКИ ПІДГОТУВАЛА СОКОЛОВСЬКА АЛЬОНА УЧЕНИЦЯ 8А КЛАСУ КНЗ ХЕЛ  Оксиды (1 курс)
Оксиды (1 курс) Витамины в нашей еде
Витамины в нашей еде Молярный объём газов
Молярный объём газов Адсорбция. Адсорбциондық тепе-теңдік
Адсорбция. Адсорбциондық тепе-теңдік Валентность и степень окисления
Валентность и степень окисления Аттестационная работа. Методическая разработка по выполнению проекта «Подгруппа углерода» для 9 класса по химии и экологии
Аттестационная работа. Методическая разработка по выполнению проекта «Подгруппа углерода» для 9 класса по химии и экологии Решение задач на вывод формул органических веществ относительно плотности
Решение задач на вывод формул органических веществ относительно плотности Железоуглеродистые сплавы
Железоуглеродистые сплавы Пластмассы или пластики
Пластмассы или пластики Кремний и его соединения
Кремний и его соединения Синтез ацетилена из природного газа в производстве ацетилена
Синтез ацетилена из природного газа в производстве ацетилена Презентация Щелочные металлы
Презентация Щелочные металлы  Презентация по Химии "Алюминий и его соединения" - скачать смотреть
Презентация по Химии "Алюминий и его соединения" - скачать смотреть  Углеводы
Углеводы Гетерофункциональные органические соединения и их производные – метаболиты и биорегуляторы
Гетерофункциональные органические соединения и их производные – метаболиты и биорегуляторы Цирконий. Схема получения чистого циркония
Цирконий. Схема получения чистого циркония Электродитическая диссоциация
Электродитическая диссоциация