Содержание
- 2. Титриметрические (объемные) методы количественного анализа основаны на точном измерении объема раствора реагента (титранта), вступающего в химическую
- 3. Титриметрия наиболее широко применяется при определении высоких и средних концентраций веществ в растворах (до 1·10-4 моль/л
- 4. Классификация титриметрических методов анализа по типам химических реакций 1. Методы кислотно-основного титрования Основаны на использовании реакции
- 5. 2. Методы осадительного титрования Исследуемое вещество при взаимодействии с титрантом образует малорастворимые соединения. Широко применяемый метод
- 6. 3. Методы комплексометрического титрования Основаны на образовании слабоионизированных комплексов титранта с исследуемым веществом. Комплексонометрическое титрование –
- 7. 4. Методы окислительно-восстановительного титрования Основаны на окислительно-восстановительных реакциях, происходящих между определяемым веществом и титрантом. Перманганатометрия. Перманганат
- 8. Броматометрия – титриметрический метод определения восстановителей, а также органических соединений, вступающих с бромом в реакции присоединения
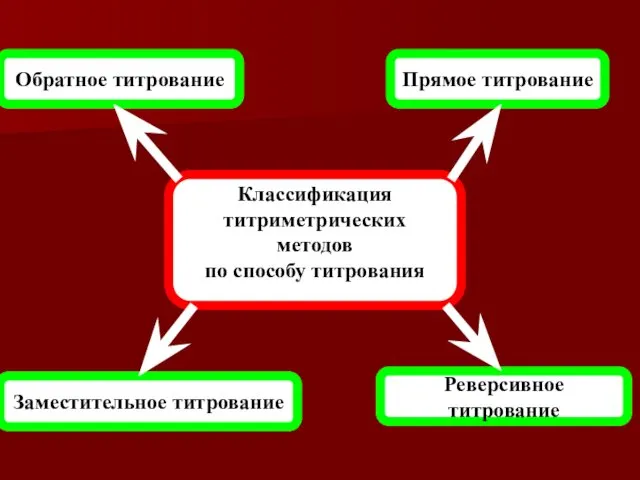
- 9. Прямое титрование Обратное титрование Заместительное титрование Реверсивное титрование Классификация титриметрических методов по способу титрования
- 10. Прямое титрование реакция взаимодействия исследуемого вещества (А) с реагентом в условиях проведения анализа должна быть специфичной;
- 11. Обратное титрование скорость прямой реакции невысокая; отсутствует соответствующий индикатор; возможна потеря определяемого вещества из-за его летучести.
- 12. Например, концентрацию раствора NH3 определяют обратным титрованием по причине его летучести. К раствору аммиака прибавляют избыток
- 13. Заместительное титрование определяемое вещество с данным титрантом не взаимодействует; взаимодействие определяемого вещества и титранта приводит к
- 14. Например, калия дихромат взаимодействует с титрантом Na2S2O3 нестехиометрично. Поэтому к раствору исследуемого вещества K2Cr2O7 прибавляют реагент
- 15. Реверсивное титрование При реверсивном титровании раствором определяемого вещества титруют стандартный раствор реагента: А(в бюретке) + Т(в
- 16. Основные виды концентраций в титриметрическом анализе Молярная Массовая Нормальная Молярная концентрация СМ равна отношению числа молей
- 17. Приготовление титрованных растворов 1. по точной навеске исходного вещества (первичный стандартный раствор);
- 18. вещество должно легко получаться в химически чистом виде, иметь состав, который точно соответствует химической формуле и
- 19. 2. с помощью "фиксанала" (первичный стандартный раствор) Приготовление титрованных растворов Фиксаналы (стандарт-титры, первичные стандарты) – вещества
- 20. 3. готовят раствор с приблизительной концентрацией, близкой к требуемой, определяют точную концентрацию с помощью стандартного вещества
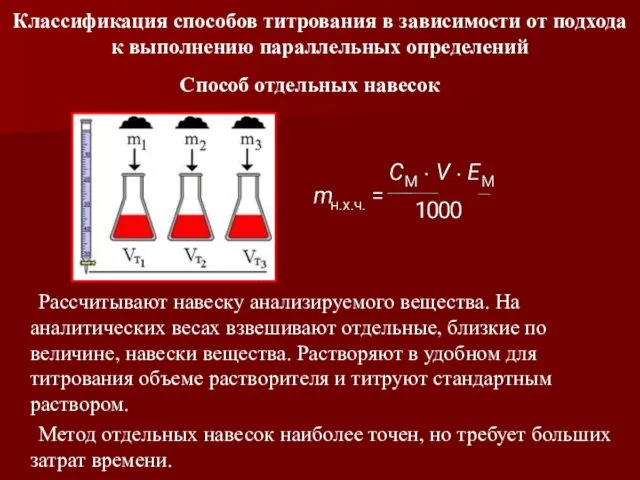
- 22. Классификация способов титрования в зависимости от подхода к выполнению параллельных определений Способ отдельных навесок Рассчитывают навеску
- 23. Рассчитывают навеску анализируемого вещества. Взвешивают на аналитических весах. Количественно переносят в мерную колбу, растворяют в растворителе
- 24. различной емкости с делениями и без делений узкогорлые и широкогорлые со шлифом и без шлифа Конические
- 25. Бюретка представляет собой градуированную стеклянную трубку с запирающим устройством на нижнем конце – краном, зажимом Мора
- 26. Техника титрования 1. Перед использованием бюретка должна быть тщательно вымыта дистиллированной водой. 2. Бюретку трижды ополаскивают
- 27. 4. Конец бюретки должен быть опущен на 1-2 см в колбу для титрования. 5. Титрование проводят
- 28. Пипетки служат для точного отмеривания определенного объема жидкости Пипетки: простые (пипетки Мора) градуированные Для наполнения пипеток
- 30. Определение конечной точки титрования - точки на кривой титрования, в которой регистрируется резкое изменение наблюдаемого свойства
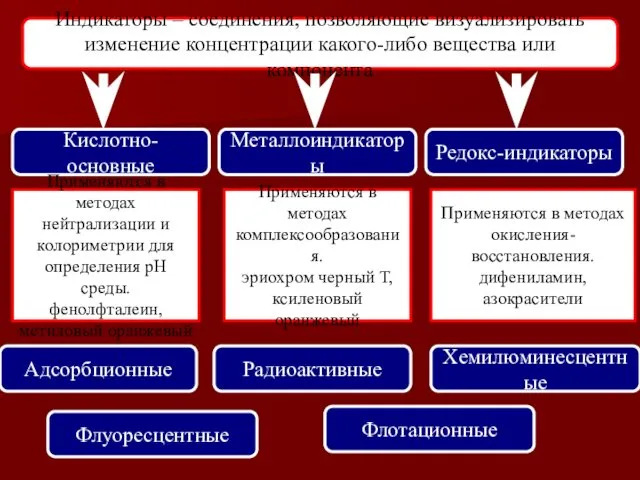
- 31. Индикаторы – соединения, позволяющие визуализировать изменение концентрации какого-либо вещества или компонента Кислотно-основные Металлоиндикаторы Редокс-индикаторы Применяются в
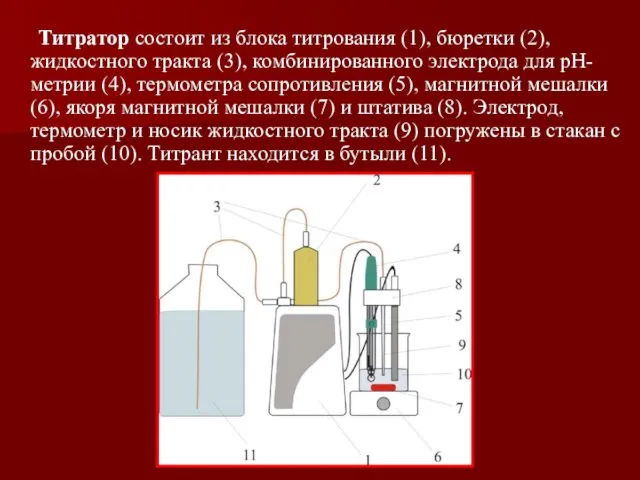
- 32. Титраторы Титраторы – приборы предназначенные для частично или полностью автоматизированного проведения измерений. Программное обеспечение, прилагаемое к
- 33. Титратор состоит из блока титрования (1), бюретки (2), жидкостного тракта (3), комбинированного электрода для рН-метрии (4),
- 34. Вещества реагируют между собой в эквивалентных количествах (или согласно своим химическим эквивалентам): n1 = n2. Используя
- 35. ω, % ω, % (прямое и заместительное титрование) (обратное титрование) Расчетные формулы в титриметрическом анализе Способ
- 36. Расчетные формулы в титриметрическом анализе Способ пипетирования согласно молярной массе эквивалента ω, % (прямое и заместительное
- 37. Кривая титрования – график зависимости параметра системы, связанного с концентрацией титруемого вещества, титранта или продукта реакции,
- 38. Титрование сильной кислоты сильным основанием и сильного основания сильной кислотой Кривая титрования – зависимость рН раствора
- 39. 1. До точки эквивалентности в растворе будет находиться избыток хлористоводородной кислоты. рН будет определяться только количеством
- 40. концентрация оставшейся кислоты после реакции Построение кривой титрования VT = 5 мл, pH = 1,48 VT
- 41. 3. После точки эквивалентности в растворе появится избыток NaOH и рН будет определяться щелочью, которая осталась
- 42. рН = 9,69 VT = 10,1 мл, pH = 10,69 VT = 11 мл, pH =
- 43. Кривая титрования 0,1 М раствора HCl 0,1 М раствором NaOH Ф МО pH V, мл
- 45. Скачать презентацию






































 Биологические молекулы
Биологические молекулы Исследование защитных свойств зубных паст. Автор работы- ученик 11 Б класса Гиря Научный руководитель- Якимова М.А. МОУ Южно-росс
Исследование защитных свойств зубных паст. Автор работы- ученик 11 Б класса Гиря Научный руководитель- Якимова М.А. МОУ Южно-росс Тотығып фосфорлану
Тотығып фосфорлану Фосфатные породы
Фосфатные породы ПОЛИСАХАРИДЫ
ПОЛИСАХАРИДЫ Презентация по Химии "Синтетические моющие средства или химия в ванной" - скачать смотреть _
Презентация по Химии "Синтетические моющие средства или химия в ванной" - скачать смотреть _ Контроль результатов обучения химии
Контроль результатов обучения химии Фракциялық айдау
Фракциялық айдау Спирты и фенолы
Спирты и фенолы Алканы. Предельные углеводороды
Алканы. Предельные углеводороды Имеет ли вода форму
Имеет ли вода форму Виды топлива и их характеристика
Виды топлива и их характеристика Экологическое образование в школьном курсе неорганической химии
Экологическое образование в школьном курсе неорганической химии Презентация по Химии "Неметаллы: атомы и простые вещества. Воздух. Кислород. Озон" - скачать смотреть
Презентация по Химии "Неметаллы: атомы и простые вещества. Воздух. Кислород. Озон" - скачать смотреть 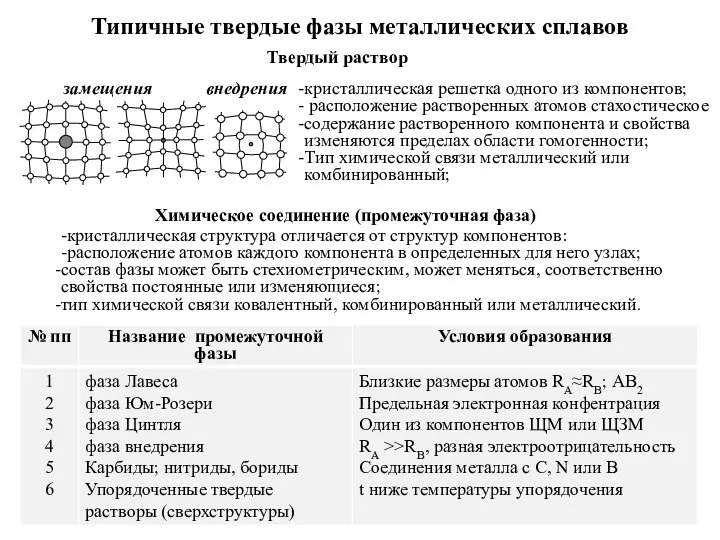 Типичные твердые фазы металлических сплавов
Типичные твердые фазы металлических сплавов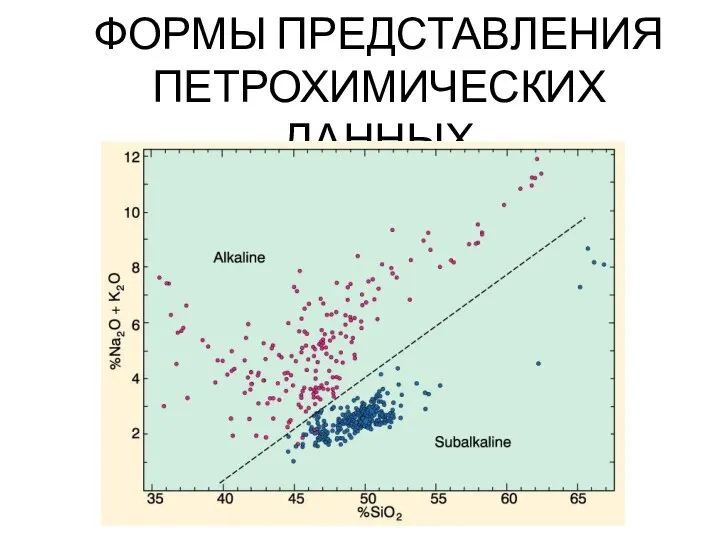 Формы представления петрохимических данных
Формы представления петрохимических данных Жизнь и творчество Д.И. Менделеева Подготовил ученик 8а Карбушев Максим
Жизнь и творчество Д.И. Менделеева Подготовил ученик 8а Карбушев Максим  Аминокислоты Модели молекул
Аминокислоты Модели молекул  Геохимические методы исследований
Геохимические методы исследований Периодическая система химических элементов Д.И. Менделеева. История развития химии
Периодическая система химических элементов Д.И. Менделеева. История развития химии Валентность химических элементов
Валентность химических элементов Предмет органической химии. Теория химического строения органических
Предмет органической химии. Теория химического строения органических Щавелевая кислота
Щавелевая кислота Исследование интерактивной компьютерной химической модели
Исследование интерактивной компьютерной химической модели Знакомство с химией
Знакомство с химией Предмет органической химии. Основные понятия. Лекция 1
Предмет органической химии. Основные понятия. Лекция 1 Строение гетероциклических соединений
Строение гетероциклических соединений Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева