Содержание
- 2. Алканы обычно представлены в нефти во всех трех агрегатных состояниях: газообразном, жидком и твердом. - Газообразные
- 3. Парафины и церезины. Нефтяные парафины - смесь преимущественно алканов разной молекулярной массы, а основной компонент церезинов
- 4. Алканы – углеводороды ряда CnH2n+2. По имени первого члена этого ряда-метана (СH4) алканы часто называют метановыми
- 5. Физические свойства алканов - Метановые углеводороды практически нерастворимы в воде; - хорошо растворимы в эфире, ароматических
- 6. Химические свойства алканов Алканы относятся к наименее реакционноспособным органическим соединениям, однако они не являются химически инертными.
- 7. Реакции замещения: 1) галогенирование
- 8. 2) нитрование
- 9. 3) Сульфохлорирование и сульфоокисление
- 10. Реакции окисления Высокотемпературное окисление алканов в избытке кислорода приводит к их полному сгоранию до СО2 и
- 11. При газофазном окислении при низких температурах образуются спирты, альдегиды, кетоны и кислоты (неполное окисление):
- 12. Реакции дегидрирования При высоких температурах и в присутствии катализаторов алканы дегидрируются и подвергаются термическому расщеплению.
- 13. Реакции термического расщепления
- 14. Реакции дегидроциклизации, изомеризации
- 15. Комплексообразование. Для метановых углеводородов характерно образование клатратных соединений (соединения включения), в которых «гостями» являются молекулы газов
- 16. Тема 2. Непредельные углеводороды: алкены, алкадиены, алкины.
- 17. - Ранее считалось, что алкены либо не содержатся в нефтях, либо содержатся в незначительных количествах. В
- 18. Алкены - ненасыщенные углеводороды, содержащие двойную связь С=С. Раньше эти соединения называли олефинами. Общая формула алкенов
- 19. Номенклатура - Наименование всех алкенов образуется из названий соответствующего алкана с заменой окончания -ан на -ен.
- 20. Алкены. Гомологический ряд изомерия, номенклатура.
- 21. Алкадиены
- 22. Алкины. Гомологический ряд, изомерия, номенклатура.
- 23. Физические свойства. - Алкены С2-С4 при нормальных условиях - газы, алкены С5-С17 - жидкости, а следующие
- 24. Химические свойства алкенов. Химические свойства алкенов определяются наличием двойной связи, углерод при двойной связи находится в
- 25. Гидрирование Галогенирование (реакция с бромной водой является качественной реакцией на алкены и др. непредельные УВ (бромная
- 26. - Гидрогалогенирование (образуются галогеналканы), - гидратация (образуются предельные одноатомные спирты) и - сульфирование протекают по правилу
- 27. Алкадиены. Химические свойства. 1. Реакции присоединения: а) гидрирование; б) галогенирование; В) гидрогалогенирование. (Д\З: написать реакции бутадиена-1,3)
- 28. Х Особым типом реакций присоединения является полимеризация этиленовых углеводородов. Непредельные соединения с сопряжёнными двойными связями обладают
- 29. Алкины. Химические свойства Химические свойства алкинов обусловлены природой тройной связи, особенностями углеродных атомов, находящихся в состоянии
- 31. Гидратация (образуется ацетальдегид в случае этина и кетоны в случае гомологов ацетилена)
- 32. 2. Реакция окисления а) горения б)неполное окисление под действием перманганата калия (образуются карбоновые кислоты) Ошибка!!!
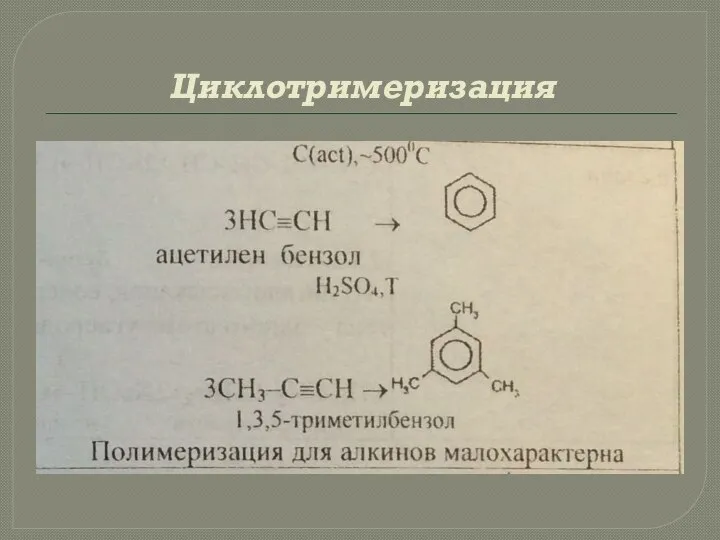
- 33. 3. Реакции ди-, три- и полимеризации
- 34. Циклотримеризация
- 35. 4. Реакции замещения (образуются нерастворимые соли – ацетилениды).
- 36. Применение ненасыщенных углеводородов в органическом синтезе Непредельные углеводороды являются важнейшим сырьём для нефтехимической промышленности. На их
- 37. Способы получения (алкены). 3. Крекинг алканов (написать реакцию крекинга пропана, н. гексана)
- 40. Способы получения (алкадиены).
- 43. Скачать презентацию







































 Презентация по Химии "Органічні сполуки і здоров’я людини." - скачать смотреть бесплатно
Презентация по Химии "Органічні сполуки і здоров’я людини." - скачать смотреть бесплатно Химическая связь
Химическая связь Використання кислот в будівництві і побуті. 8 клас
Використання кислот в будівництві і побуті. 8 клас Способи добування алкінів Презентація Учениці 11-А класу Гаджук Зорини
Способи добування алкінів Презентація Учениці 11-А класу Гаджук Зорини  Круговорот азота в природе
Круговорот азота в природе Предел упругости
Предел упругости Сульфаттар және эфирсульфаттар
Сульфаттар және эфирсульфаттар Загальна характеристика неметалічних елементів. Неметали як прості речовини. Явище алотропії, алотропні видозміни Оксигену і
Загальна характеристика неметалічних елементів. Неметали як прості речовини. Явище алотропії, алотропні видозміни Оксигену і Волокна Презентація на тему:
Волокна Презентація на тему:  Кристаллические решетки
Кристаллические решетки Презентація на тему: Каучуки Виконав: Учень 11-Б класу Путьо Михайло
Презентація на тему: Каучуки Виконав: Учень 11-Б класу Путьо Михайло  Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) 6-членные гетероциклы с одним гетероатомом
6-членные гетероциклы с одним гетероатомом Презентация по Химии "СИММЕТРИЯ В ХИМИИ" - скачать смотреть
Презентация по Химии "СИММЕТРИЯ В ХИМИИ" - скачать смотреть  Химия тория и протактиния
Химия тория и протактиния Степень диссоциации. 9 класс
Степень диссоциации. 9 класс Физические и химические явления
Физические и химические явления Синтез метилового эфира цинкофорина
Синтез метилового эфира цинкофорина Белки. Функции белков
Белки. Функции белков Виды изомерии. Углеводороды
Виды изомерии. Углеводороды Lead
Lead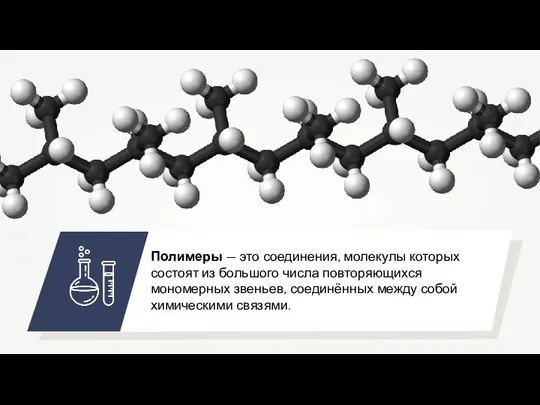 Органические и неорганические полимеры
Органические и неорганические полимеры Основные классы неорганических веществ
Основные классы неорганических веществ Над проектом работали ученики 6 класса: Над проектом работали ученики 6 класса: Крючков Слава Орлов Слава Старова Катя Пугачев Се
Над проектом работали ученики 6 класса: Над проектом работали ученики 6 класса: Крючков Слава Орлов Слава Старова Катя Пугачев Се 8 класс (обязательный минимум по химии) Теория электролитической диссоциации (ТЭД). Урок 1
8 класс (обязательный минимум по химии) Теория электролитической диссоциации (ТЭД). Урок 1 Подготовка учащихся к выполнению заданий различного уровня сложности ЕГЭ по химии
Подготовка учащихся к выполнению заданий различного уровня сложности ЕГЭ по химии Мир химических элементов
Мир химических элементов Адам ағзасындағы химиялық элементтер
Адам ағзасындағы химиялық элементтер