Содержание
- 2. Тема урока: «Угольная кислота и её соли»
- 3. Давать характеристику угольной кислоте и её свойствам. 2. Моделировать способы получения угольной кислоты 3. Рассматривать свойства
- 4. У́гольная кислота́ — слабая двухосновная кислота кислота с химической формулой H2CO3 Задание 1.Напишите уравнения реакций ступенчатой
- 5. Соли угольной кислоты NB! Двухосновная, образует 2 рода солей: средние – карбонаты (ионы CO32-) кислые –
- 6. 1. Растворением в воде углекислого газа CO2↑ + H2O H2CO3 III. Получение угольной кислоты
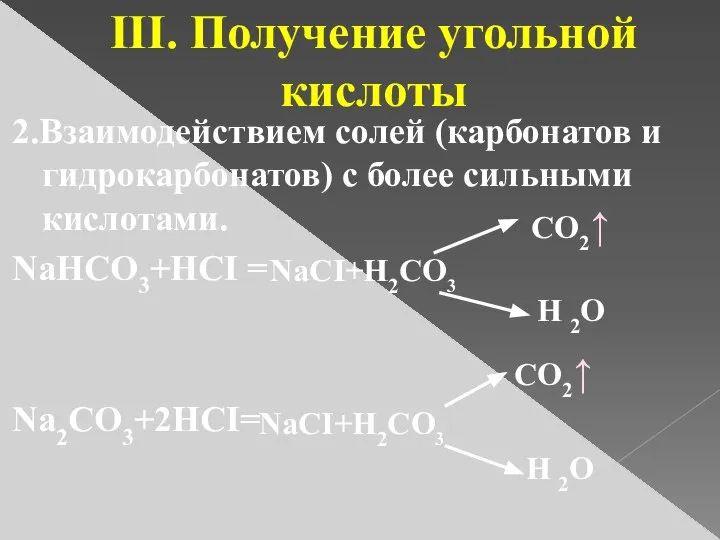
- 7. 2.Взаимодействием солей (карбонатов и гидрокарбонатов) с более сильными кислотами. NaHCO3+HCI = Na2CO3+2HCI= III. Получение угольной кислоты
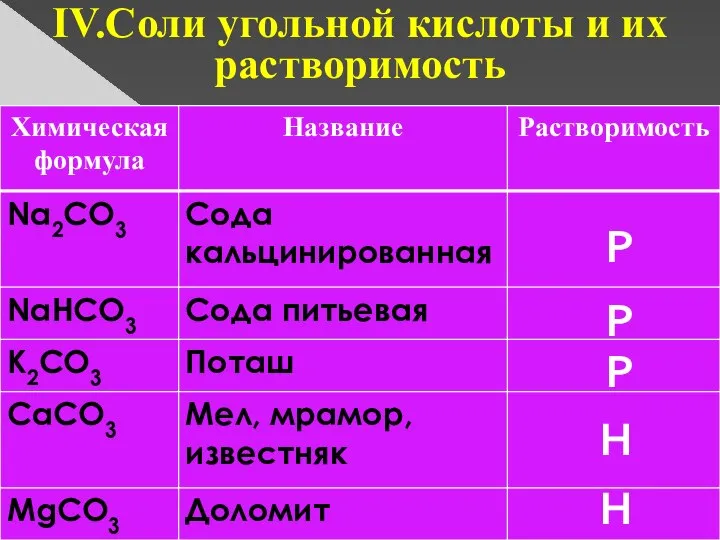
- 8. IV.Соли угольной кислоты и их растворимость Р Р Р Н Н
- 9. V.Химические свойства карбонатов и гидрокарбонатов 1) Взаимодействие гидрокарбонатов с кислотами NaНCO3 + HCl = питьевая сода
- 10. Химические свойства карбонатов и гидрокарбонатов 3) Карбонаты и гидрокарбонаты могут превращаться друг в друга СаСО3 +
- 11. Химические свойства карбонатов и гидрокарбонатов Гидрокарбонаты обуславливают временную жесткость воды. Способы устранения временной жесткости воды: 1.
- 12. Среди карбонатов особое внимание заслуживает карбонат кальция CaCO3, встречающийся в виде: известняка мрамора мела VII.Значение карбонатов
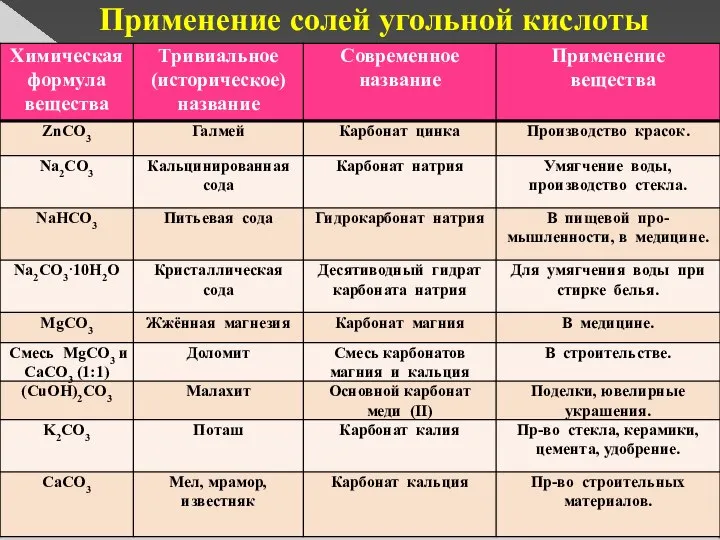
- 13. Применение солей угольной кислоты
- 14. Тест «Карбонаты» Задание 1. Напишите уравнение реакции получения карбоната кальция из гидроксида кальция Ca(OH)2+CO2= CaCO3 +
- 16. Скачать презентацию










 Растворы. Способы выражения концентрации растворенного вещества
Растворы. Способы выражения концентрации растворенного вещества Сравнительный анализ установки изомеризации между Павлодарским НПЗ и Московским НПЗ
Сравнительный анализ установки изомеризации между Павлодарским НПЗ и Московским НПЗ Воздух. Кислород. Горение. Работа выполнена: Учителем химии ГБОУ СОШ № 118 Выборгского района Санкт - Петербурга Тихомировой
Воздух. Кислород. Горение. Работа выполнена: Учителем химии ГБОУ СОШ № 118 Выборгского района Санкт - Петербурга Тихомировой Проблема химического элемента. Концепции структуры химических соединений
Проблема химического элемента. Концепции структуры химических соединений Исследование интерактивной компьютерной химической модели
Исследование интерактивной компьютерной химической модели Современные конструкционные материалы
Современные конструкционные материалы Классификация и свойства оксидов
Классификация и свойства оксидов Альдегиды и кетоны
Альдегиды и кетоны Теплова теорія припинення горіння. Вогнегасні засоби
Теплова теорія припинення горіння. Вогнегасні засоби Презентация по Химии "Железо" - скачать смотреть
Презентация по Химии "Железо" - скачать смотреть  Тема: «Бишофит – новый старый антигололедный реагент» Авторы: Гончаревич Анастасия Клокова Татьян
Тема: «Бишофит – новый старый антигололедный реагент» Авторы: Гончаревич Анастасия Клокова Татьян Радиоактивные элементы почв
Радиоактивные элементы почв Свойства алмаза
Свойства алмаза Решение задач. Алкины
Решение задач. Алкины Эксперимент. Принципы теории планирования эксперимента. Классификация и виды экспериментов
Эксперимент. Принципы теории планирования эксперимента. Классификация и виды экспериментов Стекла. Структура и свойства
Стекла. Структура и свойства Производные бензгидрола, фенола и анилина. (Тема 4)
Производные бензгидрола, фенола и анилина. (Тема 4) Использование углеводородов в медицине
Использование углеводородов в медицине Метаболизм триацилглицеринов
Метаболизм триацилглицеринов Пластмассы полимеризационного и поликонденсационного получения. Группа № Анисимов Роман Соловьева Алеся Столбов Никита У
Пластмассы полимеризационного и поликонденсационного получения. Группа № Анисимов Роман Соловьева Алеся Столбов Никита У Теория химического строения органических соединений А.М. Бутлерова (ТХС)
Теория химического строения органических соединений А.М. Бутлерова (ТХС) Функции металлов в истинном металлоферменте. (Лекция 16)
Функции металлов в истинном металлоферменте. (Лекция 16) Органическая химия Скорость химических реакций
Органическая химия Скорость химических реакций  Янтарь – солнечный камень. Рассказ об удивительном минерале
Янтарь – солнечный камень. Рассказ об удивительном минерале Характеристика 1-й аналитической группы анионов
Характеристика 1-й аналитической группы анионов Лекарственные растения и сырье, содержащие жиры и жироподобные вещества. (Лекция 6)
Лекарственные растения и сырье, содержащие жиры и жироподобные вещества. (Лекция 6) ХИМИЧЕСКИЕ СВОЙСТВА СЕРНОЙ КИСЛОТЫ
ХИМИЧЕСКИЕ СВОЙСТВА СЕРНОЙ КИСЛОТЫ Загадки химии. Занятие 2
Загадки химии. Занятие 2