Содержание
- 2. Серная кислота – один из важнейших продуктов, характеризующий общий уровень развития химической промышленности страны. Объем производства
- 3. Способы получения серной кислоты Исходное вещество – сернистый ангидрид SO2 (образуется в результате сжигания серы или
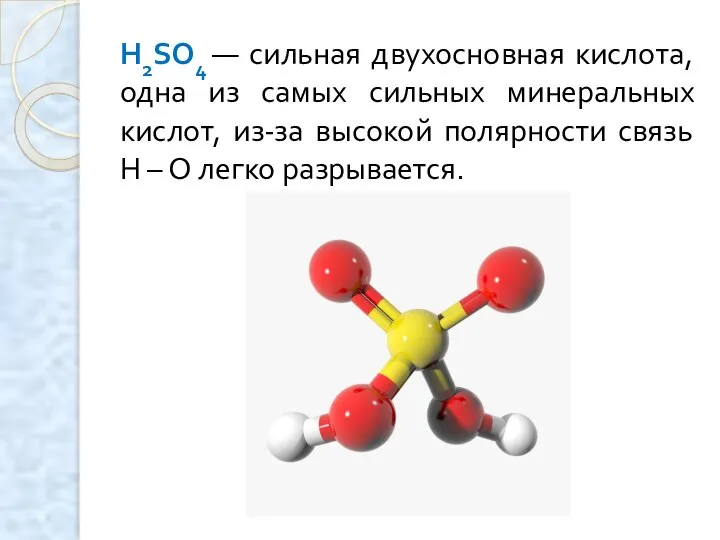
- 4. H2SO4 — сильная двухосновная кислота, одна из самых сильных минеральных кислот, из-за высокой полярности связь Н
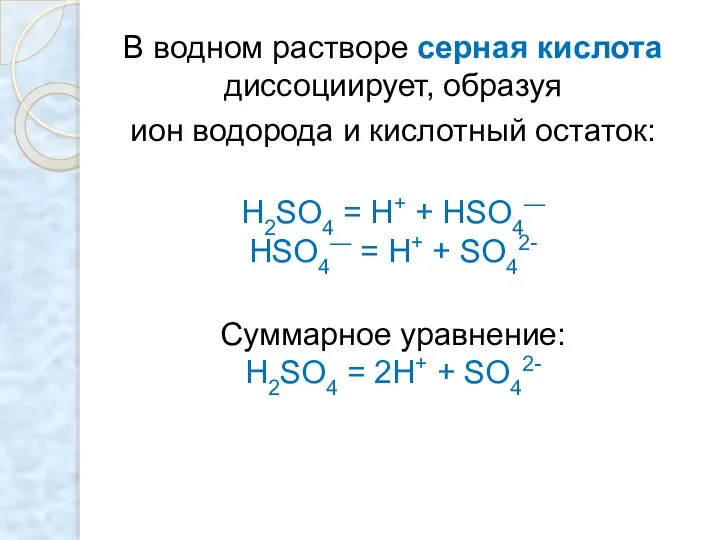
- 5. В водном растворе серная кислота диссоциирует, образуя ион водорода и кислотный остаток: H2SO4 = H+ +
- 6. Взаимодействие серной кислоты с металлами: разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее
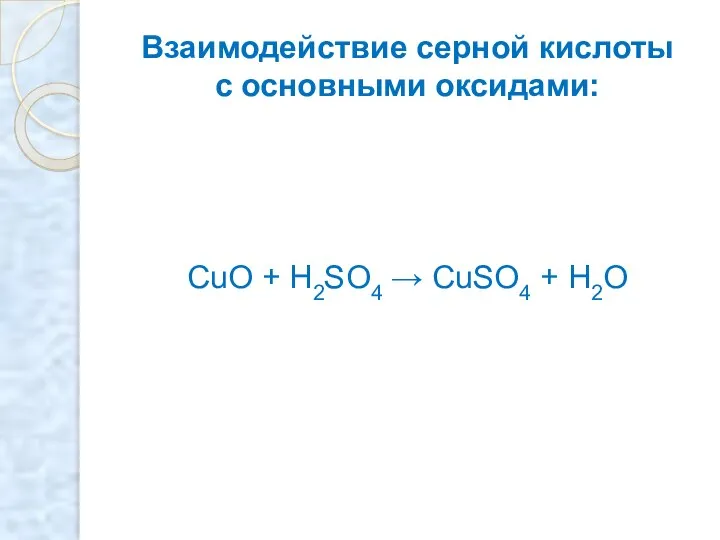
- 7. Взаимодействие серной кислоты с основными оксидами: CuO + H2SO4 → CuSO4 + H2O
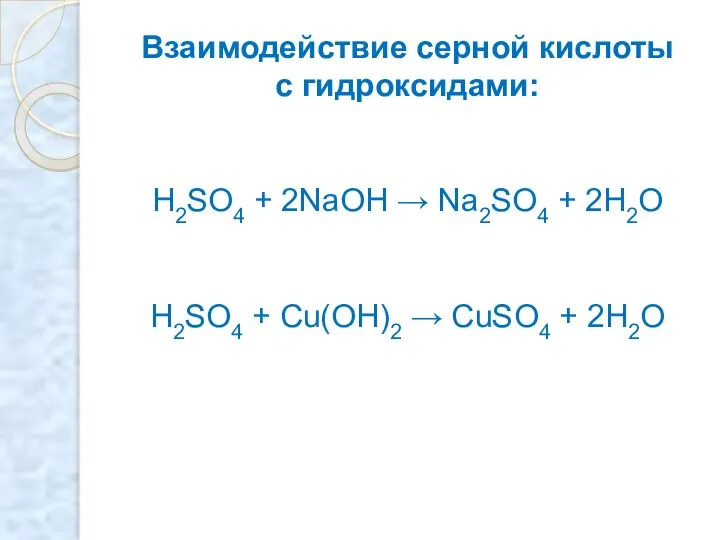
- 8. Взаимодействие серной кислоты с гидроксидами: H2SO4 + 2NaOH → Na2SO4 + 2H2O H2SO4 + Cu(OH)2 →
- 9. Обменные реакции с солями: BaCl2 + H2SO4 → BaSO4↓ + 2HCl Образование белого осадка BaSO4 (нерастворимого
- 10. Особые свойства концентрированной H2SO4 : 1. Концентрированная серная кислота является сильным окислителем; при взаимодействии с металлами
- 11. Серная кислота отнимает химически связанную воду от органических соединений, содержащих гидроксильные группы. Дегидратация этилового спирта в
- 12. ВЫВОД Широкое использование серной кислоты объясняется ее химической активностью: она реагирует почти со всеми металлами, их
- 14. Скачать презентацию







 Валентность и степень окисления. Химическая связь
Валентность и степень окисления. Химическая связь Химический состав клетки
Химический состав клетки Программа дополнительного образования «Химия, здоровье и окружающая среда»
Программа дополнительного образования «Химия, здоровье и окружающая среда» Аминокислоты Модели молекул
Аминокислоты Модели молекул Распределение Бозе-Эйнштейна. Конденсация Бозе-газа. Температура конденсации. Число частиц в конденсате
Распределение Бозе-Эйнштейна. Конденсация Бозе-газа. Температура конденсации. Число частиц в конденсате Галогены. Основные химические свойства. Качественные реакции
Галогены. Основные химические свойства. Качественные реакции Тела. Вещества. Частицы. Разнообразие веществ
Тела. Вещества. Частицы. Разнообразие веществ Презентация по Химии "Презентация Кристаллическая решетка" - скачать смотреть
Презентация по Химии "Презентация Кристаллическая решетка" - скачать смотреть  Железный век или немного из истории
Железный век или немного из истории Природа и классификация химических связей
Природа и классификация химических связей Строение и функция белков
Строение и функция белков Металлы. XV раздел Недрагоценные металлы и изделия из них. Перемещение через таможенную границу
Металлы. XV раздел Недрагоценные металлы и изделия из них. Перемещение через таможенную границу Коррозия металлов. Лекция 7
Коррозия металлов. Лекция 7 Азотная кислота. Получение, свойства. Нитраты, азотные удобрения
Азотная кислота. Получение, свойства. Нитраты, азотные удобрения Презентация по Химии "Алкины. Ацетилен" - скачать смотреть
Презентация по Химии "Алкины. Ацетилен" - скачать смотреть  А.Д. Сахаров – выдающийся ученый и правозащитник современности МБОУ «Гимназия № 13», 9 «Б» класс. Выполнил: Артёмов Александр. На
А.Д. Сахаров – выдающийся ученый и правозащитник современности МБОУ «Гимназия № 13», 9 «Б» класс. Выполнил: Артёмов Александр. На Состав и номенклатура аминокислот. Превращение и функции белков в организме
Состав и номенклатура аминокислот. Превращение и функции белков в организме Броуновское движение
Броуновское движение Кругообіг води в природі
Кругообіг води в природі  Целевой и содержательный компоненты процесса обучения химии
Целевой и содержательный компоненты процесса обучения химии Электрохимические процессы
Электрохимические процессы Железо, хром, марганец. Свойства, получение
Железо, хром, марганец. Свойства, получение Серная кислота. (9 класс)
Серная кислота. (9 класс) Презентация по Химии "Серная кислота – хлеб химии" - скачать смотреть
Презентация по Химии "Серная кислота – хлеб химии" - скачать смотреть  Содержание ртути и её соединений в воздухе при использовании осветительных ламп
Содержание ртути и её соединений в воздухе при использовании осветительных ламп Электролитическая диссоциация
Электролитическая диссоциация Устойчивость и коагуляция золей
Устойчивость и коагуляция золей Состав воды. Минералы + грязь + примеси
Состав воды. Минералы + грязь + примеси